【问题情景】某化学实验小组的同学将铁粉投入硫酸铜溶液中,发现生成红色固体物质的同时有较多气泡放出。这一现象激发起同学们的探究欲望:生成了什么气体?
【提出猜想】从物质组成元素的角度,放出的气体可能是SO2、O2、H2。
【查阅资料】SO2易溶于水,它能与NaOH溶液反应,生成Na2SO3。
【方案设计】依据上述猜想,实验小组同学分别设计了如下方案:
(1)甲同学认为是O2,则检验方法是 。
(2)乙同学认为是SO2,则只需将放出的气体通入盛有NaOH溶液的洗气瓶中,称量通气前后洗气瓶的质量。写出SO2与NaOH溶液反应的化学方程式 。
(3)实验小组同学合作设计了如图组合实验方案,排除和验证猜想的气体。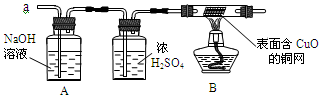
如果放出的是O2和H2,你认为方案中的安全隐患是 ,丙同学认为:为确保安全,实验前应先收集一试管气体,然后 ,若听到 ,方可采用上面的装置进行实验;如果听到 ,则不能采用上述装置。
【实验探究】经丙同学确认安全后,小组同学首先对装置A进行称量,再将收集到的气体从a通入,过一会儿点燃B处酒精灯;一段时间后,发现表面含CuO的铜网由黑色变为光亮的红色;停止通气,再次称量装置A,发现质量无增减。
(4)结论:铁粉与硫酸铜溶液反应时,产生的气体是 。
(5)由上述实验可以推出,硫酸铜溶液中可能含有 。(填物质化学式)
(6)不通过称量,如何判断SO2与NaOH溶液发生了反应呢?有一同学设计了下图所示的装置进行实验,发现试管内液面上升,就得出SO2与NaOH溶液发生反应的结论。其他同学认为这一方案不严谨,理由是 。要得到科学严谨的结论,仍利用该装置,需要补做的实验是 。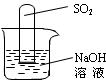
同学们学习了分子、原子、离子是构成物质常见的基本粒子,它们的质量和体积都很小。某化学兴趣小组的同学对粒子体积大小有没有差异进行了如下探究:
【查阅资料】
鸡蛋膜有极其微小的孔隙。
【实验探究】
如图所示:向5个鸡蛋壳内分别加入下表中的物质,放入盛有蒸馏水的小烧杯中,一段时间后取出鸡蛋壳,再向小烧杯中分别加入如表中的物质进行实验。
|
实验编号 |
① |
② |
③ |
④ |
⑤ |
|
鸡蛋壳内加入的物质 |
溶液 |
溶液 |
溶液 |
淀粉溶液 |
鸡蛋清 |
|
小烧杯中加入的物质 |
溶液 |
溶液 |
溶液 |
碘水 |
浓硝酸 |
|
小烧杯中的现象 |
白色沉淀 |
|
红褐色沉淀 |
无现象 |
无现象 |
【实验分析】
(1)实验①小烧杯中产生的白色沉淀是 ;实验③小烧杯中产生红褐色沉淀,反应的化学方程式为 。
(2)通过实验①②③得出的结论是 。
【实验结论】
综上实验探究可知:构成物质的基本粒子的体积 。
【反思交流】
小明同学认为上述实验④⑤不能比较分子体积大小差异,还应增加下列对比实验进行完善:将实验④鸡蛋壳内和小烧杯中物质互换,重复上述实验操作,小烧杯中的现象是 。
【拓展延伸】
科学家设计制造出孔径大小不同的“小筛子”,让体积大小不同的粒子通过,从而分离提纯物质。如天然水的净化、海水淡化。

(1)实验室制取某种气体X,X可能为氢气、氧气或二氧化碳。回答下列问题:

①图中用于加热试管的仪器名称是 。
②若将装置A和E连接制取气体X,A中反应的化学方程式为 。
③若用装置B和F制取气体X,装置中a和c相连,则气体X是 。
(2)长途运输活鱼常向水中加入过氧化钙( )固体。某探究小组对过氧化钙进行了如下探究活动。
【探究活动1】
①将一定量的过氧化钙加入水中,缓慢产生气泡(经检验该气体能使带火星的木条复燃);
②取少量反应后的液体于试管中,滴加酚酞试液,溶液变红。据此得出反应的化学方程式为 。
【探究活动2】
另取①中上层清液,加入 溶液,充分反应后有沉淀生成,生成沉淀的化学方程式为 。过滤,得到滤渣和滤液。
【提出问题】滤液中溶质的成分是什么?
【作出猜想】猜想一:
猜想二:
猜想三: 、
【实验探究】取少量滤液,向其中加入足量稀盐酸, (填写实验现象),猜想三成立。
【反思交流】根据以上探究事实,你认为过氧化钙的用途有 (写一条即可)。
燃烧与灭火紧密联系着我们的生活。请你依据下列实验探究,回答相关问题。

(1)在空气中点燃镁条,观察到镁条剧烈燃烧,发出耀眼白光,说明该反应 (填“放出”或“吸收”)能量,生成白色固体 ,说明镁发生了 反应(填“氧化”或“还原”)。
(2) 可用于灭火,是否也可熄灭燃着的镁呢?某实验小组进行了如下探究:
①实验探究
取两块大小相同的干冰,在一块干冰中央挖一个小穴,放入一些镁屑,用红热的铁棒点燃镁屑。(见图1)
迅速将另一块干冰盖上,镁在两块干冰间剧烈反应,发出耀眼的白光,像冰块中装入一个明亮的电灯泡一样。(见图2和图3)
取走上面一块干冰,观察到有白色固体产生(见图4),用铁片拨开图4产物的表面(见图5),还观察到的现象是 ,写出该反应的化学方程式 。
②反思交流
小组实验后讨论,对初中教材中燃烧的条件有了新的认识,请你代为表达。 。
我国化学家侯德榜创立的侯氏制碱法,为世界制碱工业作出了突出贡献。在工业生产所得的碳酸钠产品中往往会混有少量的氯化钠。某校化学兴趣小组同学想探究某产品中碳酸钠的质量分数,经讨论后设计了如下两种实验方案。
【查阅资料】碱石灰的主要成分是 和 。
【设计与实验】
方案甲:“气体质量法”

(1)按如图所示连接好装置,检查装置气密性后加入一定质量的碳酸钠样品于装置A中。
(2)打开止水夹K通入一段时间的氮气后,称量装置C的质量,并记录。
(3)关闭止水夹K,打开分液漏斗活塞向A装置中注入足量的稀硫酸,关闭活塞。
(4)待装置A中无气泡产生后打开止水夹K,再次通入氮气一段时间后,关闭止水夹K,第二次称量装置C的质量,并记录。
(5)计算。
【分析与讨论】
①装置A中发生反应的化学方程式为 。
②装置B中浓硫酸的作用是 。
③步骤(4)中再次通入氮气的目的是 。
④装置D的作用是 。
方案乙:“沉淀质量法”

写出上述流程中相关反应的化学方程式: 。
【得出结论】
同学们经过实验,最终都计算出了样品中碳酸钠的质量分数。
请你根据方案乙中测定的相关数据,求出样品中碳酸钠的质量分数为 ×100%(用含有m、n的代数式表示)。
【反思与交流】
同学们经过讨论认为方案乙优于方案甲,理由主要是 (填字母序号)。
| A. |
节约能源 |
| B. |
操作简便 |
| C. |
保护环境 |
其兴趣小组同学在老师的指导下,进入实验室对碳酸钙进行了一系列探究。回答下列问题:
Ⅰ.碳酸钙与盐酸反应
(1)装置A中仪器a的名称为 。
(2)装置B中的现象是 。
(3)装置C若用于检验生成的气体,其中试剂为 (写名称),发生反应的化学方程式为 。
Ⅱ.碳酸钙分解
碳酸钙在电炉中高温煅烧一段时间后,对剩余固体进行探究。
【提出问题】剩余固体成分是什么?
【猜想与假设】猜想一:全部是碳酸钙
猜想二:是碳酸钙和氧化钙的混合物
猜想三:全部是氧化钙
【设计并完成实验】
|
实验操作 |
实验现象 |
解释与结论 |
|
步骤一:取剩余固体于试管中,加水振荡后静置 |
底部有白色不溶物 |
\ |
|
步骤二:取上层清液于另一试管中,滴加氯化铜溶液 |
有 |
上层清液中一定含有氢氧化钙 |
|
步骤三:取部分底部白色不溶物于第三支试管中,滴加过量稀盐酸 |
有气泡产生 |
白色不溶物中一定含有 |
【实验结论】正确的猜想是 。
【交流与反思】小芳同学认为,步骤二中还可滴加其他试剂用来替代氯化铜溶液,该试剂可以是 (写一种即可);小华同学认为,只需完成步骤一和步骤三即可获得相同实验结论,他的依据是 。
【拓展与分析】查阅资料:生石灰质量的优劣常采用“活性度”来衡量。“活性度”的测定方法:取一定质量的生石灰,加入一定量的水,用一定溶质质量分数的盐酸中和,记录所消耗盐酸的体积(单位为mL)。消耗盐酸的体积数越大,“活性度”越高。
测得煅烧产物( )的活性度,数据见如表。

石灰石煅烧的最佳温度范围一般为1100℃~1200℃的证据是 。
