材料与人类生活紧密相关,下列物质不属于金属材料的是
| A.用于制造人造骨的钛合金 | B.电线中的铜丝 |
| C.钻探机钻头上的金刚石 | D.用于焊接金属的焊锡 |
下列图示实验操作中,不正确的是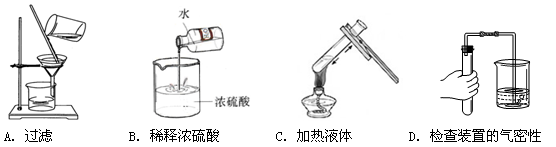
下列过程中,主要发生了化学变化的是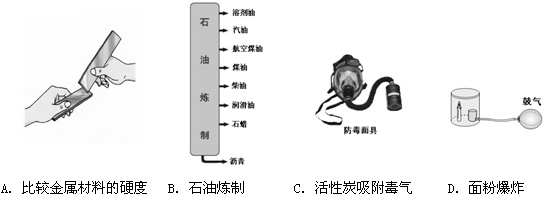
下列推理不正确的是
①燃烧过程中伴随着发光放热,所以有发光放热现象的变化一定是燃烧
②分子可以构成物质,所以物质一定是由分子构成的
③单质只含一种元素,所以含一种元素的物质一定是单质
④物理变化没有新物质生成,所以没有新物质生成的变化一定是物理变化
⑤氧化物都含有氧元素,所以含有氧元素的化合物一定是氧化物
| A.①②③⑤ | B.①②⑤ | C.①③④ | D.③⑤ |
餐厅的服务员用盖子熄灭酒精炉,该灭火方法的主要原理是
| A.隔绝空气 | B.降低温度 |
| C.清除可燃物 | D.降低可燃物的着火点 |