下列关系互为同分异构体的是
| A.35Cl和37Cl | B.CH3CH2OH和CH3OCH3 |
| C.CH3CH3和CH3CH2CH3 | D.H2O和H2O2 |
将适量的物质分别加到干燥的红色布条上,不能使其褪色的是()
| A.新制的氯水 | B.氯化钙溶液 |
| C.液氯 | D.用盐酸酸化的次氯酸钠溶液 |
下列离子方程式正确的是 ( )
| A.碳酸钙加入盐酸中: CaCO3+2H+=Ca2++CO2↑+H2O |
| B.铁片加入CuSO4溶液中: 2Fe+3Cu2+=3Cu+2Fe3+ |
| C.稀硫酸加入氢氧化钡溶液 2H++SO42-+Ba2++2OH-=BaSO4↓+H2O |
| D.氯化铜溶液中加入NaOH溶液:Cu2++OH-=Cu(OH)2↓ |
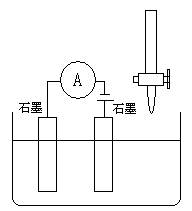
下列哪种情况能使下图装置中的溶液导电性呈现“强-弱-强”变化的是 ( )
| A.将50mL 0.1mol/L的H2SO4溶液慢慢加入50mL 0.1mol/L的Ba(OH)2溶液中; | B.将50mL 0.1mol/L的NaCl溶液慢慢加入50mL 0.1mol/L的AgNO3溶液中 |
| C.在50mL 饱和澄清石灰水中通入CO2直至过量 | |
| D.在50mL 0.1mol/L的CH3COOH溶液中慢慢加入50mL 0.1mol/L的NaOH溶液 |
用硫酸酸化的三氧化铬(CrO3)遇酒精后,其颜色由红变为蓝绿色,用这种现象可测得司机是否是酒后驾车.反应如下
2CrO3 + 3C2H5OH + 3H2SO4 = Cr2(SO4)3 + 3CH3CHO + 6H2O
此反应的还原剂是: ( )
| A.H2SO4 | B.CrO3 | C.Cr2(SO4)3 | D.C2H50H |
除去下列溶液中的杂质(括号内为杂质),选择试剂不正确的是 ( )
| A.HNO3(HCl)―――用AgNO3 |
| B.NaOH(Ba(OH)2)―――用Na2SO4 |
| C.NaCl(Na2SO4)―――用Ba(NO3)2 |
| D.KOH(K2CO3)―――用Ca(OH)2 |