某学生以铁丝和Cl2为原料进行下列三个实验。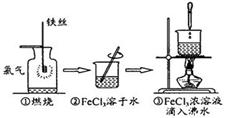
从分类角度下列分析正确的是
| A.实验①、③反应制得的物质均为纯净物 |
| B.实验②、③均未发生氧化还原反应 |
| C.实验②、③均为放热反应 |
| D.实验①、②所涉及的物质均为电解质或非电解质 |
在100mL密度为1.2g/mL稀硝酸中,加入一定量的镁和铜组成的混合物,充分反应后金属完全溶解(假设还原产物只有NO),向反应后溶液中加入3mol/L NaOH溶液至沉淀完全,测得生成沉淀质量比原金属质量增加5.1g。则下列叙述不正确是
| A.当金属全部溶解时收集到NO气体的体积为2.24L(标准状况) |
| B.当生成沉淀的量最多时,消耗NaOH溶液体积最小为100mL |
| C.原稀硝酸的物质的量浓度一定为4 mol/L |
| D.参加反应金属总质量(m)为9.6g>m>3.6g |
向一定量的Fe﹑FeO﹑Fe2O3的混合物中,加入100mL1mol/L的盐酸恰好使混合物完全溶解,放出224mL(标准状况)的气体,所得溶液中加入KSCN溶液,无血红色出现.则混合物中铁元素质量分数为
| A.81.4% | B.77.8% | C.68.6% | D.无法确定 |
右表是元素周期表的一部分,X、Y、Z、W均为短周期元素,下列说法不正确的是
| X |
Y |
||
| Z |
W |
A.原子半径:Z>X>Y
B.若Z的最高价氧化物遇Y的氢化物溶液混合后有气体放出,则W的氢化物不稳定
C.若Y、W的质子数之和为23,则Z能形成碱性氧化物
D.若X能形成两种常见液态化合物,则W单质的溶液有漂白性
向等物质的量浓度的NaOH和Na2CO3的混合溶液中加入稀盐酸。下列离子方程式与事实不相符的是
| A.OH―+CO32―+2H+→HCO3―+H2O |
| B.2OH―+CO32―+3H+→HCO3―+2H2O |
| C.2OH―+CO32―+4H+→CO2↑+3H2O |
| D.OH―+CO32―+3H+→CO2↑+2H2O |
下列离子方程式正确的是
| A.0.01mol/L NH4Al(SO4)2溶液与0.02mol/L Ba(OH)2溶液等体积混合 NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3·H2O |
| B.FeCl2酸性溶液放在空气中变质:2Fe2++4H++O2===2Fe3++2H2O |
| C.用CH3COOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑ |
D.电解MgCl2水溶液的离子方程式:2Cl-+2H2O H2↑+Cl2↑+2OH- H2↑+Cl2↑+2OH- |