某无色稀溶液X中,可能含有下表所列离子中的某几种
| 阴离子 |
CO32-、SiO32-、AlO2-、Cl- |
| 阳离子 |
Al3+、Fe3+、Mg2+、NH4+、Na+ |
现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂Y体积(V)的关系如图所示,下列说话正确的是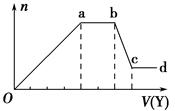
A.若Y是盐酸,则Oa段转化为沉淀的离子(上表中,下同)只有AlO2-
B.若Y是盐酸,则溶液中可能含有的阳离子是Al3+。
C.若Y是NaOH溶液,则bc段反应的离子方程式为 Al(OH)3+OH-=AlO2-+2H2O
D.若Y是NaOH溶液,则X溶液中只存四种离子是:Al3+、Fe3+、NH4+、Cl-
下列叙述正确的是( )
| A.0.1 mol/L CH3COONa溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| B.NH4Cl溶液加水稀释后,恢复至原温度,pH和KW均增大 |
| C.pH=4的CH3COOH溶液和pH=4的NH4Cl溶液中,c(H+)不相等 |
| D.在NaHCO3溶液中:c(OH-)+c(CO32—)=c(H+)+c(H2CO3) |
下列叙述正确的是( )
A.pH相等的CH3COONa、NaOH和Na2CO3三种溶液浓度大小关系为:c(NaOH)<c(CH3COONa)<c(Na2CO3)
B.0.1 mol/L的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)
C.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2
D.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
K、Ki、KW分别表示化学平衡常数、电离常数和水的离子积,下列判断正确的是( )
| A.在500 ℃、20 MPa、5 L的密闭容器中进行合成氨的反应,使用催化剂后K值增大 |
| B.室温下K(HCN)<K(CH3COOH),说明CH3COOH的电离度一定比HCN大 |
| C.25 ℃时,pH 均为4的盐酸和NH4I(aq)中KW不相等 |
D.2SO2+O2 2SO3达平衡后,改变某一条件K值不变,SO2的转化率可能增大、减小或不变 2SO3达平衡后,改变某一条件K值不变,SO2的转化率可能增大、减小或不变 |
下列实验过程中产生的现象与图中曲线变化相对应的是( )
化工生产中常用MnS作沉淀剂除去工业废水中的Cu2+:Cu2+(aq)+MnS(s)CuS(s)+Mn2+(aq),下列说法错误的是( )
| A.MnS的Ksp比CuS的Ksp大 |
| B.该反应达平衡时c(Mn2+)=c(Cu2+) |
| C.往平衡体系中加入少量CuSO4固体后,c(Mn2+)变大 |
D.该反应的平衡常数K= |