[化学—选修3:物质结构与性质]
(1)锌是一种重要的金属,锌及其化合物有着广泛的应用。
①指出锌元素在周期表中的位置: 周期, 族, 区。
②NH3分子中氮原子的杂化轨道类型为 ,基态氮原子的核外电子排布式是 ;
③下图表示锌与某非金属元素X形成的化合物晶胞,其中Zn和X通过共价键结合,该化合物的化学式为 ;该化合物的晶体熔点比干冰高得多,原因是 。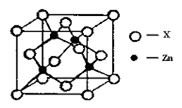
(2)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。
①已知金刚石中的C-C的键长为154.45pm,C60中C-C键长为140-145pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确 ,并阐述理由 。
②科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物质在低温时是一种超导体。该物质的K原子和C60分子的个数比为 。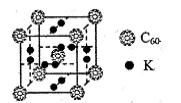
③继C60后,科学家又合成了Si60、N60。C、Si、N原子电负性由大到小的顺序是 。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则 Si60分子中的数目为 。
(6分)写出下列反应的离子方程式:
(1)用稀硫酸清洗铁锈(Fe2O3)
(2)碳酸钠溶液与盐酸混合
(3)向足量澄清石灰水中通入二氧化碳
新近出版的《前沿科学》杂志刊发的中国环境科学研究院研究员的论文《汽车尾气污染及其危害》,其中系统地阐述了汽车尾气排放对大气环境及人体健康造成的严重危害。目前降低尾气的可行方法是在汽车排气管上安装催化转化器。NO和X气体均为汽车尾气的成分,这两种气体在催化转换器中发生反应: ①2X(g)+2NO(g) N2(g)+2CO2(g)△H=-a kJ·mol-1。
N2(g)+2CO2(g)△H=-a kJ·mol-1。
(1)上述信息中气体X的化学式为 。
(2)已知②2NO(g)+O2(g)=2NO2(g)△H=-b kJ·mol-1;X的燃烧热△H=-c kJ·mol-1。书写在消除汽车尾气中NO2的污染时,NO2与X的可逆反应的热化学反应方程式 。
(3)在一定温度下,将1.0mol NO、1.2mol气体X通入到固定容积为2L的容器中,反应过程中部分物质的浓度变化如图所示:
①有害气体NO的转化率为,0~15min NO的平均速率v(NO)=。
②20min时,若改变反应条件,导致X浓度增大,则改变的条件可能是(选填序号)。
| A.缩小容器体积 | B.增加CO2的量 | C.升高温度 | D.加入催化剂 |
③若保持反应体系的温度不变,20min时再向容器中充入NO、N2各0.4mol,化学平衡将移动(选填“向左”、“向右”或“不”)。
(1)臭氧可用于净化空气、饮用水消毒、处理工业废物和作为漂白剂。
①臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如:
6Ag(s)+O3(g)===3Ag2O(s);△H =" -235.8" kJ/mol;
己知:2 Ag2O(s)===4Ag(s)+O2(g);△H = +62.2kJ/mol;
则反应 2O3(g)= 3O2(g)的△H = kJ/mol;
②科学家P.Tatapudi等人首先使用在酸性条件下电解水的方法制得臭氧。臭氧在阳极周围的水中产
生,阴极附近的氧气则生成过氧化氢,阴极电极反应式为。 (2)用活性炭还原法处理氮氧化物,有关反应为:C(s)+2NO(g)N2(g)+CO2(g)某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1℃) 条件下反应,反应进行到不同时间测得各物质的浓度如下:
(2)用活性炭还原法处理氮氧化物,有关反应为:C(s)+2NO(g)N2(g)+CO2(g)某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1℃) 条件下反应,反应进行到不同时间测得各物质的浓度如下:
①在10 min~20 min的时间段内,以CO2表示的反应速率为;
②写出该反应的平衡常数的表达式K=;
③下列各项能作为判断该反应达到平衡状态的是(填序号字母);
| A.容器内压强保持不变 | B.2v正(NO)=v逆(N2) |
| C.容器内CO2的体积分数不变 | D.混合气体的密度保持不变 |
④30 min时改变某一条件,反应重新达到平衡,则改变的条件可能是;
⑤一定温度下,随着NO的起始浓度增大,则NO的平衡转化率 (填“增大”、“不变”或“减小”)。
(1)已知:蒸发1 mol Br2(l)需要吸收的能量为 30 kJ,其他相关数据如下表:
| 物质 |
H2(g) |
Br2(g) |
HBr(g) |
| 1 mol分子中化学键断裂时需要吸收的能量/kJ |
436 |
200 |
369 |
H2(g)+Br2(l)=2HBr(g) ΔH=。
(2)常温下,将pH均为2的氢溴酸、乳酸(α—羟基丙酸)稀释100倍后,有一种酸的pH=4。请写出乳酸钠溶液中的水解离子方程式: 。
(3)常温下,用0.100 0 mol·L-1 NaOH溶液分别滴定20.00 mL 0.100 0 mol·L-1 HBr溶液和20.00 mL0.100 0 mol·L-1 CH3COOH溶液,得到2条滴定曲线,如图所示:
①根据图1和图2判断,滴定HBr溶液的曲线是(填“图1”或“图2”);
②a=mL;
③c(Na+)=c(CH3COO-)的点是点;
④E点对应溶液中离子浓度由大到小的顺序为。
(13分)有机物A有如下转化关系,在A的质谱图中质荷比最大值为88,其分子中C、H、O三种元素的质量比为6:1:4且A不能使Br2的CCl4溶液褪色;1molB反应生成了2molC.
请回答下列问题:
(1)C→E的反应类型为____________
(2)若①、②、③三步反应的产率分别为93.0%、81.0%、88.0%,则由A合成H的总产率为____________
(3)A的结构简式为___________________·
(4)写出C与银氨溶液反应的离子方程式为____________________________________
(5)H分子中所有碳原子均在一条直线上,G转化为H的化学方程式为__________________
(6)X是A的一种同分异构体,且其核磁共振氢谱有3个峰,峰面积之比为1:1:2,1mol X可在HIO4加热的条件下反应,产物只有1mol Y,则X的结构简式为____________