(16分)硫代硫酸钠(Na2S2O3)商品名“海波”,俗名“大苏打”,分析化学上常用于滴定实验。某化学兴趣小组在实验室制备硫代硫酸钠晶体并探究其化学性质
已知:Na2SO3 + S = Na2S2O3
I.制备Na2S2O3
(1)如图,组装好仪器,检验完气密性(气密性良好),各装置试剂均装入后的下一步操作是______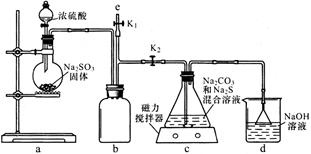
(2)反应开始后,C中发生了多个化学反应。写出其中任意一个非氧化还原反应的方程式_____________
(3)装置c中反应结束后, 先关闭分液漏斗旋塞,在e处连 接盛NaOH溶液的注射器,再关闭K2打开K1,其目的是______。待c中溶液冷却后,倒入蒸发皿,通过加热蒸发、冷却结晶和干燥等操作获得Na2S2O3·5H2O晶体。
Ⅱ.探究Na2S2O3的部分化学性质
【提出假设】
假设一:Na2S2O3与Na2SO4结构相似,化学性质也应该相似,因此室温时Na2S2O3溶液pH=7。
假设二:从S元素的化合价推测Na2S2O3具有较强的还原性。
【验证假设】配制适量Na2S2O3溶液,进行如下实验(请填空)
| |
实验操作 |
实验现象 |
现象解释(用离子方程式表示) |
| 假设一 |
___________________ |
溶液pH=8 |
________________________ |
| 假设二 |
向溴水中滴入适量Na2S2O3溶液 |
溴水褪色 |
___________________________ |
【实验结论】__________________
Ⅲ:用Na2S2O3的溶液测定溶液中ClO2的物质的量浓度,可进行以下实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100 mL试样。
步骤2:量取V1mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇匀,在暗处静置30分钟。(已知:ClO2+I-+H+—I2+Cl-+H2O 未配平)
步骤3:以淀粉溶液作指示剂,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。(已知:I2+2S2O32-=2I-+S4O62-)
根据上述步骤计算出原ClO2溶液的物质的量浓度为 mol·L-1(用含字母的代数式表示)
实验室以苯甲醛为原料制备间溴苯甲醛(实验装置见下图,相关物质的沸点见附表)。其实验步骤为:
步骤1:将三颈瓶中的一定配比的无水
、1,2-二氯乙烷和苯甲醛充分混合后,升温至60℃,缓慢滴加经浓硫酸干燥过的液溴,保温反应一段时间,冷却。
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液。有机相用10%
溶液洗涤。 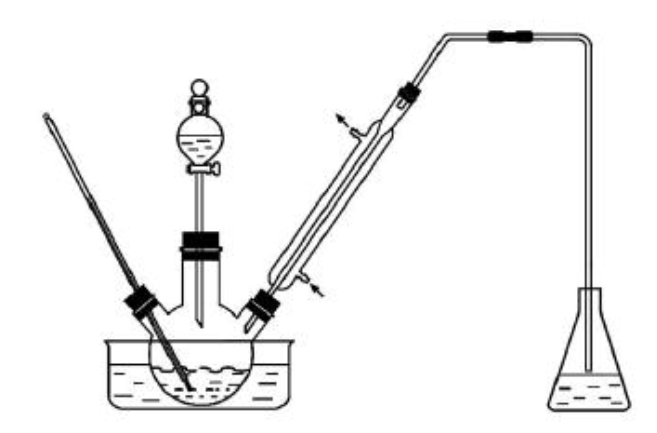
步骤3:经洗涤的有机相加入适量无水
固体,放置一段时间后过滤。
步骤4:减压蒸馏有机相,收集相应馏分。
(1)实验装置中冷凝管的主要作用是,锥形瓶中的溶液应为。
(2)步骤1所加入的物质中,有一种物质是催化剂,其化学式为。
(3)步骤2中用10%
溶液洗涤有机相,是为了除去溶于有机相的(填化学式)。
(4)步骤3中加入无水
固体的作用是。
(5)步骤4中采用减压蒸馏技术,是为了防止
附表相关物质的沸点(101kPa)
| 物质 |
沸点/℃ |
物质 |
沸点/℃ |
| 溴 |
58.8 |
1,2-二氯乙烷 |
83.5 |
| 苯甲醛 |
179 |
间溴苯甲醛 |
229 |
实验室用下图所示装置制备
溶液,并通过
溶液与
溶液的反应制备高效水处理剂
。已知
具有下列性质①可溶于水、微溶于浓
溶液,②在0℃--5℃、强碱性溶液中比较稳定,③在
和
催化作用下发生分解,④在酸性至弱碱性条件下,能与水反应生成
和
。
(1)装置A中
与盐酸反应生成
和
,其离子方程式为。将制备的
通过装置B可除去(填化学式)。
(2)
和KOH在较高温度下反应生成
。在不改变KOH溶液的浓度和体积的条件下,控制反应在0℃~5℃进行,实验中可采取的措施是。
(3)制备
时,
饱和溶液与
饱和溶液的混合方式为。
(4)提纯
粗产品[含有
、
等杂质]的实验方案为:将一定量的
粗产品溶于冷的3mol·L-1
溶液中,(实验中须使用的试剂有:饱和
溶液,乙醇;除常用仪器外须使用的仪器有:砂芯漏斗,真空干燥箱)。
工业上,向500-600℃的铁屑中通入氯气生产无水氯化铁;向炽热铁屑中通入氯化氢生产无水氯化亚铁。现用如图所示的装置模拟上述过程进行试验。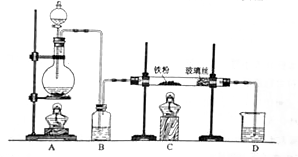
回答下列问题:
(1)制取无水氯化铁的实验中,
中反应的化学方程式为,装置
中加入的试剂是。
(2)制取无水氯化亚铁的实验中,装置
用来制取。尾气的成分是。若仍用
的装置进行尾气处理,存在的问题是、。
(3)若操作不当,制得的
会含有少量
,检验
常用的试剂是。欲制得纯净的
,在实验操作中应先,再。
硫代硫酸钠俗称“海波”,又名“大苏打”,溶液具有弱碱性和较强的还原性,是棉织物漂白后的脱氯剂,定量分析中的还原剂。硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得,装置如图(a)所示。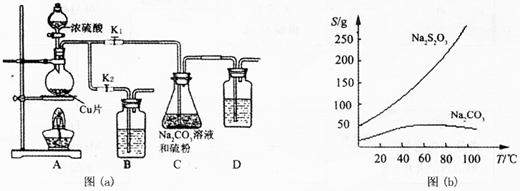
已知:Na2S2O3在酸性溶液中不能稳定存在,有关物质的溶解度曲线如图(b)所示,
(1)Na2S2O3·5H2O的制备:
步骤1:如图连接好装置后,检查A、C装置气密性的操作是.
步骤2:加入药品,打开K1、关闭K2,加热。装置B、D中的药品可选用下列物质中的(填编号)。
A.NaOH溶液B.浓H2SO4
C.酸性KMnO4溶液D.饱和NaHCO3溶液
步骤3:C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少。当C中溶液的pH时,打开K2、关闭K1并停止加热;C中溶液要控制pH的原因是。
步骤4:过滤C中的混合液,将滤液经过加热浓缩,趁热过滤,再将滤液、过滤、、烘干,得到产品。
(2)Na2S2O3性质的检验:
向足量的新制氯水中滴加少量Na2S2O3溶液,氯水颜色变浅,检查反应后溶液中含有硫酸根,写出该反应的化学方程式,
(3)常用Na2S2O3溶液测定废水中Ba2+浓度,步骤如下:取废水25.00 mL,控制适当的酸度加入足量K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解.此时CrO24全部转化为Cr2O2-7;再加过量KI溶液,充分反应后,加入淀粉溶液作指示剂,用0.010 mol·L-1的Na2S2O3溶液进行滴定,反应完全时,消耗Na2S2O3溶液18. 00 mL。部分反应的离子方程式为:
Cr2O72-+6I-+14H+=3I2+2Cr3++3I2+7H2O
I2+2S2O32-=S4O62-+2I-
则该废水中Ba2+的物质的量浓度为。
(本题共12分)阿司匹林( )是世界上应用最广泛的解热、镇痛药。因乙酸很难与酚羟基酯化,工业上以水杨酸(
)是世界上应用最广泛的解热、镇痛药。因乙酸很难与酚羟基酯化,工业上以水杨酸(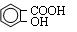 )与乙酸酐[(CH3CO)2O]为主要原料合成阿司匹林。粗产品中主要的副产物是水杨酸多聚物,需进一步提纯。反应原理和相关物理数据如下:
)与乙酸酐[(CH3CO)2O]为主要原料合成阿司匹林。粗产品中主要的副产物是水杨酸多聚物,需进一步提纯。反应原理和相关物理数据如下:
| 名称 |
常温下状态 |
水中溶解性 |
| 乙酸酐 |
液 |
与水反应 |
| 阿司匹林 |
固 |
冷水中微溶;热水中易溶 |
| 水杨酸多聚物 |
固 |
难溶 |
下图是工业上制备并提纯阿司匹林的部分流程: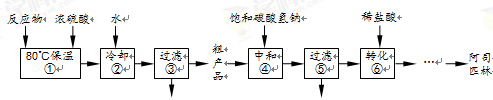
完成下列填空:
37.步骤①的反应装置如图所示(加热装置未画出),实验仪器必须干燥的原因是_____________;冷凝管的作用是___________;对烧瓶进行加热的合适方法是____________。
38.反应中加入的乙酸酐是过量的,过量的目的是_____________;步骤②中加入水的目的是使乙酸酐转化为乙酸,同时放出大量的热,需冷却至常温再进行过滤,冷却的目的是______;检验步骤③所得滤液中是否含有水杨酸,可选用的试剂是______(写化学式)。
39.步骤④中加入NaHCO3的目的是_________________。
40.步骤⑤过滤得到的滤渣主要是_____________。步骤⑥中加入盐酸后发生反应的化学方程式为______。
41.从步骤⑥到成品纯阿司匹林的剩余操作依次有_____________________。