高铁酸盐是一种强氧化剂,在能源、环保等方面均有广泛的用途。湿法、干法制备高铁酸钾的原理如下表所示:
| 湿法 |
强碱介质中,Fe(NO3)3与NaClO反应得到紫红色高铁酸盐溶液 |
| 干法 |
Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸钾(K2FeO4)和KNO2等产物 |
(1)某工厂用湿法制备高铁酸钾的流程如图所示: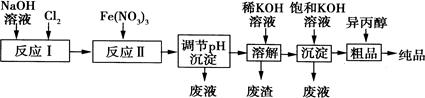
①反应I的化学方程式为 。
②反应Ⅱ的离子方程式为 。
③已知25℃时Fe(OH)3的Ksp=4.0×10—38,反应Ⅱ后的溶液中c(Fe3+)=4.0×10—5mol·L—1.则需调整pH= 时,开始生成Fe(OH)3沉淀(不考虑溶液体积的变化)。
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠溶液中加入饱和KOH溶液,即可析出高铁酸钾。
①已知高铁酸钠和水反应,有Fe(OH)3和O2生成,则高铁酸钠的氧化性比O2 (填“强”或“弱”)。
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠 (填“大”或“小”)。
(3)高铁酸钾是一种理想的水处理剂,其处理水的原理为 。
(4)干法制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为 。
已知:氯代烃可以与苯在催化剂剂下反应生成氯代苯和氯化氢;苯与浓硫酸作用可以生成苯磺酸。现以十二烷和苯为原料生产对十二烷基苯磺酸钠。写出反应的化学方程式(其它无机原料自选)。
思思同学在总结“构造原理、能量最低原理、泡利原理、洪特规则”后得出了:“在同一原子里,没有运动状态完全相同的电子存在”的结论。
你认为此结论是否正确,请说明理由。
1996年诺贝尔化学奖授予对发现 C60有重大贡献的三位科学家。C60分子是形如球状的多面体,如右图,该结构的建立基于以下考虑:C60分子中每个碳原子只跟相邻的3个碳原子形成化学键;C60分子只含有五边形和六边形;碳与碳之间既有单键又有双键,每个碳原子仍然满足四个价键饱和.
多面体的顶点数、面数和棱边数的关系,遵循欧拉定理:
顶点数 + 面数 - 棱边数 =" 2" 。
请回答:
(1)一个C60分子中有多少个五边形和多少个六边形?
(2)一个C60分子中有多少个C=C?
(3)已知C70分子的结构模型也遵循C60的那些规律,请确定C70分子结构中上述几项参数。
试用杂化轨道理论分析为什么BF3的空间构型是平面三角形,而NF3是三角锥形的?
你认为水的哪些物理性质与氢键有关?试把你的结论与同学讨论交流。