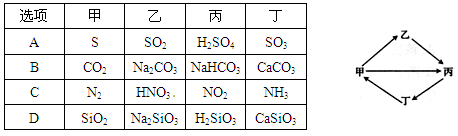
下列有关Fe2(SO4)3溶液的叙述正确的是
| A.该溶液中,K+、Fe2+、C6H5OH、Br-可以大量共存 |
| B.和KI溶液反应的离子方程式:Fe3++2I-===Fe2++I2 |
| C.1L 0.1mol/L该溶液和足量的Zn充分反应,生成11.2 g Fe |
| D.和Ba(OH)2溶液反应的离子方程式: Fe3++SO42-+Ba2++3OH-===Fe(OH)3↓+BaSO4↓ |
将4mol A和2mol B放入2 L密闭容器中发生反应2A(g) + B(g) 2C(g) ΔH<0。
2C(g) ΔH<0。
4 s后反应达到平衡状态,此时测得C的浓度为0.6 mol/L。下列说法正确的是
A.达到平衡状态后,若温度不变,缩小容器的体积,则A的转化率增大,平衡常数增大
B.当c(A)︰c(B)︰c(C)=2︰1︰2时,该反应即达到平衡状态
C.达到平衡状态后,若只升高温度,则C的物质的量浓度增大
D.4 s内,υ(B)=0.075 mol/(L ·s)
.已知:2H2(g)+O2(g)===2H2O(l)ΔH=-571.6 kJ·mol-1
2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l)ΔH=-1452 kJ·mol-1
H+(aq)+OH-(aq)===H2O(l)ΔH=-57.3 kJ·mol-1
下列说法正确的是
| A.H2(g)的燃烧热为571.6 kJ·mol-1 |
| B.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多 |
| C.1/2H2SO4(aq)+1/2Ba(OH)2(aq)===1/2BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1 |
| D.3H2(g)+CO2(g)=CH3OH(l)+H2O(l) ΔH=+135.9 kJ·mol-1 |
.短周期金属元素甲—戊在元素周期表中的相对位置如右表所示,下面判断正确的是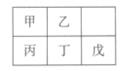
| A.原子半径:丙<丁<戊 | B.金属性:甲>丙 |
| C.最外层电子数:甲>乙 | D.氢氧化物碱性:丙>丁>戊 |
.下列图示中关于铜电极的连接错误的是 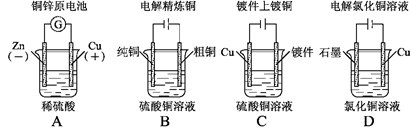
.下列各组物质按如图所示转化关系每一个转化都能一步实现的是