某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+xB(g) 2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如下图所示。下列说法中正确的是
2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如下图所示。下列说法中正确的是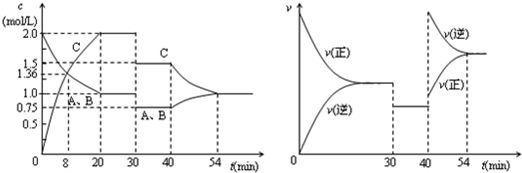
| A.30min时降低温度,40min时升高温度 |
| B.反应方程式中的x=1,正反应为吸热反应 |
| C.8min前A的平均反应速率为0.08mol/(L•min) |
| D.30min~40min间该反应使用了催化剂 |
下列广告语在科学性上没有错误的是
| A.这种矿泉水绝对纯净,不含任何离子 |
| B.这种饮料中不含任何化学物质 |
| C.这种口服液含有丰富的氮、磷、锌等微量元素 |
| D.没有水就没有生命 |
观察下图,若用1 L水来代表地球上的总水量,要比较精确地量取地球上的淡水量,应选择的仪器是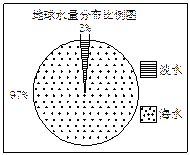
| A.100 mL烧杯 | B.50 mL烧杯 | C.100 mL量筒 | D.50 mL量筒 |
制备卤磷酸钙荧光粉所用的高纯氯化钙中混有氯化镁杂质,除去的方法是把氯化钙的水溶液加热到90~95℃,在不断搅拌下加入适当的沉淀剂,使镁生成沉淀过滤除去。此沉淀剂最好选用
| A.氢氧化钙乳浆 | B.碳酸钠溶液 | C.碳酸氢钠溶液 | D.氢氧化钠溶液 |
保护环境是每一个公民的责任。下列做法:① 推广使用无磷洗衣粉② 城市垃圾分类处理③ 推广使用一次性木质筷子④ 推广使用清洁能源⑤ 过量使用化肥、农药⑥ 推广使用无氟冰箱。其中有利于保护环境的是
| A.①②④⑤ | B.②③④⑥ | C.①②④⑥ | D.③④⑤⑥ |
与近代化学的诞生无关的是
| A.化学元素的概念 | B.英国化学家、物理学家波义耳 |
| C.著名物理学家爱因斯坦 | D.古代的化学实践活动 |