二草酸合铜(Ⅱ)酸钾晶体{K2[Cu(C2O4)2]·2H2O}制备流程如下: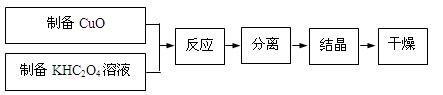
(已知:H2C2O4 CO↑+CO2↑+H2O)
CO↑+CO2↑+H2O)
(1)制备CuO:CuSO4溶液中滴入NaOH溶液,加热煮沸、冷却、双层滤纸过滤、洗涤。
①用双层滤纸过滤的原因是 。
②用蒸馏水洗涤氧化铜时,如何证明氧化铜已洗涤干净 。
(2)为了提高CuO的利用率,如何让CuO充分转移到热的KHC2O4溶液中 ;50℃水浴加热至反应充分,发生反应的化学方程式为 ;再经趁热过滤、沸水洗涤、将滤液蒸发浓缩得到二草酸合铜(Ⅱ)酸钾晶体。
(3)本实验用K2CO3粉末与草酸溶液反应制备KHC2O4,而不用KOH粉末代替K2CO3粉末,其主要原因是 。
(4)二草酸合铜(Ⅱ)酸钾晶体的制备也可以用CuSO4晶体和K2C2O4溶液反应得到。从硫酸铜溶液中获得硫酸铜晶体的实验步骤为:加入适量乙醇、蒸发浓缩、冷却结晶、过滤、洗涤、干燥。①加入适量乙醇的优点有:
a.缩短加热的时间,降低能耗;
b. 。
②在蒸发浓缩的初始阶段还采用了如图所示的装置,其目的是 。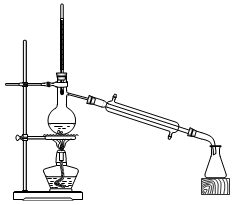
(10分)欲用含有少量氯化钙的氯化钠固体,配制100 mL 1mol/L的氯化钠溶液,设计了下面的操作方案。根据方案操作步骤回答下列问题: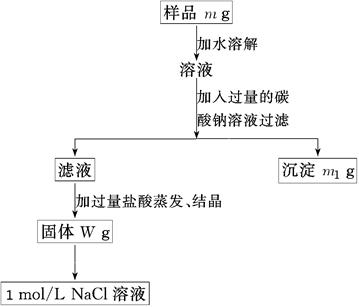
⑴称量粗盐样品m g,样品放在托盘天平左盘上。
⑵过滤时,需用到的玻璃仪器除烧杯、玻璃棒外有。
⑶蒸发操作时应将液体放在______中加热,等加热至________时即停止加热。
⑷在样品的溶液中加入过量的Na2CO3溶液,作用是____________________________,反应的离子方程式是______________________。
⑸在滤液中加入盐酸的作用是________________,发生反应的化学方程式是___________。
⑹配制100 mL 1mol/L的NaCl溶液时,应从W g固体中称取NaCl的质量为____________。
实验室配制500ml 2mol·L-1的H2SO4溶液
(1)500ml 2mol·L-1的H2SO4溶液中所含溶质的质量是g。
(2)配制时,所需仪器应该有烧杯、玻璃棒、量筒、、。
(3)容量瓶在使用前,首先应检查。
(4)此实验中,玻璃棒的两个作用分别是、。
(5)下列操作会使配制的溶液浓度偏低的是(选填序号)
| A.没有将洗涤液转移到容量瓶 | B.定容时俯视刻度线 |
| C.容量瓶洗净后未干燥 | D.转移过程中有少量溶液测出 |
(12分)下图为苯和溴取代反应的改进实验装置。其中A为带支管的试管改制成的反应容器,在其下端开了一个小孔,塞好石棉绒,再加入少量铁屑。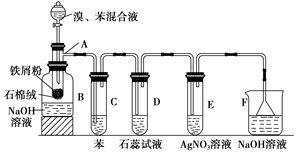
填写下列空白:
(1)向反应容器A中逐滴加入溴和苯的混合液,几秒钟内就发生反应。写出A中所发生反应的化学方程式(有机物写结构简式):_______________________________________。
(2)试管C中苯的作用是________________________________________________;
反应开始后,观察D试管,看到的现象为______________________________________。
(3)在上述整套装置中,具有防倒吸作用的仪器有_________________________(填字母)。
(4)改进后的实验除①步骤简单,操作方便,成功率高;②各步现象明显;③对产品便于观察这三个优点外,还有一个优点是____________________________________________。
某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯

(1)制备粗品
将12.5 mL环己醇加入试管A中,再加入l mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是____________,导管B除了导气外还具有的作用是_________。
②试管C置于冰水浴中的目的是______________________________。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在_______层(填上或下),分液后用_______ (填入编号)洗涤。
A.KMnO4溶液 B.稀H2SO4 C. Na2CO3溶液
②再将环己烯按下图装置蒸馏,冷却水从_________口进入,目的是__________________。
③收集产品时,控制的温度应在左右。以下区分环己烯精品和粗品的方法,合理的是_________。
A用酸性高锰酸钾溶液 B用金属钠 C测定沸点
已知Cl2+H2O  HCl+HClO。为了探究HClO的漂白性,某同学设计了如下的实验。
HCl+HClO。为了探究HClO的漂白性,某同学设计了如下的实验。
(1)通入Cl2后,从集气瓶A中干燥的红色布条没有褪色的现象可得出的结论是;
从集气瓶B中湿润的红色布条的现象可得出的结论是。
(2)为了确证是HClO使湿润的红色布条褪色,你认为还应增加的实验是。