根据原子结构及元素周期律的知识,下列推断正确的是
A.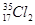 与 与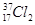 氧化能力相近,二者互为同位素 氧化能力相近,二者互为同位素 |
B.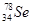 与 与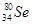 所含质子数相同,中子数不同 所含质子数相同,中子数不同 |
| C.同主族元素形成的含氧酸的酸性随核电荷数的增加而减弱 |
| D.同周期主族元素形成的简单离子半径随核电荷数的增大而减小 |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.使甲基橙变红色的溶液中:NO3-、CO32-、NH4+、Na+ |
| B.使酚酞变红色的溶液中:HCO3-、NO3-、Ba2+、K+ |
| C.0.1mol/LCaCl2的溶液中:HCO3-、NO3-、Na+、K+ |
| D.0.1mol/LFeCl3的溶液中:Mg2+、Na+、Cl-、SCN- |
下列化学用语正确的是
| A.乙酸的结构简式:C2H4O2 |
B.氮气的结构式:N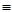 N N |
C.硫化氢的电子式: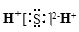 |
D.氯原子的结构示意图: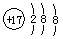 |
“纳米材料”是指直径从几纳米至几十纳米的材料,目前已广泛应用于催化剂及军事技术中,如果将纳米材料分散到液体分散剂中,所得混合物
| A.“纳米材料”实质是分子材料 |
| B.“纳米材料”是电解质 |
| C.该混合物外观完全不同于溶液 |
| D.有丁达尔效应 |
900℃时,向1.0L恒容密闭容器中充入0.40mol乙苯,发生反应: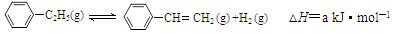 。经一段时间后达到平衡。反应过程中测定的部分数据见下表:
。经一段时间后达到平衡。反应过程中测定的部分数据见下表:
| 时间/min |
0 |
10 |
20 |
30 |
40 |
| n(乙苯)/mol |
0.40 |
0.30 |
0.24 |
n2 |
n3 |
| n(苯乙烯)/mol |
0.00 |
0.10 |
n1 |
0.20 |
0.20 |
下列说法正确的是
A.反应在前10 min的平均速率为v(H2)=0.01mol·L-1·min-1
B.保持其他条件不变,升高温度,平衡时,c(H2)=0.22mol·L-1,则a<0
C.保持其他条件不变,压缩容器的体积为原来的一半,则乙苯的转化率大于50.0%
D.相同温度下,起始时向容器中充入0.10mol乙苯、0.10mol苯乙烯和0.20molH2,达到平衡前v(正)>v(逆)
常温下,下列溶液中有关微粒的物质的量浓度关系正确的是
A.0.1 mol·L-1 (NH4)2Fe(SO4)2溶液:c(SO42-)>c( )>c(Fe2+)>c(H+) )>c(Fe2+)>c(H+) |
B.0.1 mol·L-1 NaHCO3溶液:c(Na+)+c(H+)=c( )+c( )+c( )+c(OH-) )+c(OH-) |
| C.0.1 mol·L-1Na2S溶液:2c(Na+) =c(S2-)+c(HS-) +c(H2S) |
| D.0.01 mol·L-1NaOH溶液与等体积pH=2的醋酸混合后的溶液:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |