(13分)过氧化钙是一种新型的多功能无机化工产品,常温下是无色或淡黄色粉末,易溶于酸。难溶于水、乙醇等溶剂。某实验小组在实验室用钙盐制取Ca02·8H20沉淀(该反应是一个放热反应)。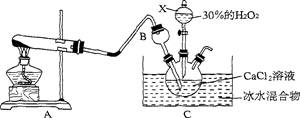
(1)仪器X的名称是 。将装置A与B连接后要检查气密性,检查气密性的方法为
(2)仪器B的作用是 。
(3)写出A中发生反应的化学方程式: 。
(4)制取CaO2·8H20一般在0~5℃的低温下进行,原因是 .生成CaO2·8H20的 化学方程式为 。
(5)2.76 g CaO2·8H20样品受热脱水过程的热重曲线(样品质量随温度变化的曲线,140℃时完全脱水,杂质受热不分解)如图所示。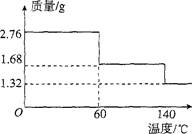
①试确定60℃时CaO2·xH20中x= 。
②该样品中CaO2的质量分数为 。
某探究小组废弃的印刷线路板(含Cu、A1少量Au、Pt等金属的混合物)回收Cu并制备硫酸铝晶体[A12(SO4)3.18H2O],设计路线如下:
(1)过滤时所需要的玻璃仪器有玻璃棒、、。
(2)实验时需对滤渣2进行洗涤,判断洗涤是否干净的实验操作方法是。
(3)为确定加入铁粉的量,实验中需测定滤液1中Cu2+的量。实验操作为:除去H2O2;准确量取一定体积滤液1于带塞锥形瓶中,加水稀释,调节溶液pH=3-4,加入过量KI-淀粉溶液,用Na2S2O3标准溶液滴定至终点。上述过程中反应的离子方程式: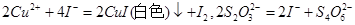
①滴定管在注入Na2S2O3标准溶液之前,要先用蒸馏水洗净,再用。
②滴定终点观察到的现象为。
③若滴定前溶液中的H2O2没有除尽,所测定的 含量将会(填“偏高”、“偏
含量将会(填“偏高”、“偏
低”或“不变”)
(4)由滤液2制取硫酸铝晶体,探究小组设计了如下二种方案:
甲: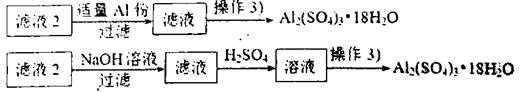
乙:
①操作③的实验步骤依次为:蒸发浓缩:、、洗涤。
②从原子利用率角度考虑,方案更合理。(填“甲”或“乙”)
(5)他们查阅了资料,认为通过先氧化、再调节溶液pH也可将滤液2中的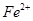 除去。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mo1.L-1计算)。
除去。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mo1.L-1计算)。
| 开始沉淀的pH |
沉淀完全的pH |
|
| Fe3+ |
1.1 |
3.2 |
| Fe2+ |
5.8 |
8.8 |
| A13+ |
3.8 |
5.2 |
①氧化需加入H2O2而不用C12的原因是。
②调节溶液pH约为。
、某液态卤代烷RX(R是烷基,X是某种卤原子)的密度是a g·cm-3。RX可以与稀碱发生水解反应生成ROH(能跟水互溶)和HX。为了测定RX的相对分子质量,拟定的实验步骤如下:
①准确量取该卤代烷bmL,放入锥形瓶中。
②在锥形瓶中加入过量稀NaOH溶液,塞上带有长玻璃管的塞子,加热,发生反应。
③反应完成后,冷却溶液,加稀硝酸酸化,滴加过量AgNO3溶液得到白色沉淀。
④将沉淀过滤、洗涤、干燥后称重,得到固体c g 。
回答下列问题:
(1)装置中长玻璃管的作用是。
(2)步骤④中洗涤的目的是为了除去沉淀吸附的离子。
(3)该卤代烷中所含卤素的名称是,判断依据是。
(4)该卤代烷的相对分子质量是(列出算式)。
(5)如果在步骤③中,加HNO3的量不足,没有将溶液酸化,则步骤④测得的c值 _________(填下列选项代码)。
| A.偏大 | B.偏小 | C.不变 | D.大小不定 |
实验室配制500mL 0.1mol/LNa2CO3溶液回答下列问题
(1)应用托盘天平称取十水碳酸钠晶体(Na2CO3·10H2O)_______g
(2)用托盘天平和小烧杯称出碳酸钠晶体的质量,其正确操作顺序的标号为____________
A.调整零点
B.将碳酸钠晶体放入小烧杯中称量
C.称量空的小烧杯
D.将砝码放回砝码盒内
E.记录称量结果
(3)配制Na2CO3溶液时需用的主要仪器有托盘天平、滤纸、烧杯、药匙、_________ 、_________ 、_________ 。
(4)若实验遇下列情况,溶液的浓度是偏高,偏低还是不变?
A.加水时超过刻度线_________ ;
B.忘记将洗涤液转入容量瓶_________;
C.容量瓶内壁附有水珠而未干燥处理_________;
D.定容后摇匀液面低于刻度线_________ 。
E.转移时有少量液体溅出_________。
某实验需要100 mL、1 mol/L的Na2CO3溶液,现通过如下操作配制:
① 把称量好的固体Na2CO3放入小烧杯中,加适量蒸馏水溶解。为加快溶解可以使用(填仪器名称)搅拌
②把①所得溶液冷却到室温后,小心转入(填仪器名称)
③继续加蒸馏水至液面至刻度线1~2cm处,改用(填仪器名称)小心滴加蒸馏水至溶液凹液面最低点与刻度线相切
④用少量蒸馏水洗涤玻璃棒和烧杯2~3次,每次洗涤的溶液都小心转入容量瓶,并轻轻摇匀
⑤将容量瓶塞紧,充分摇匀。
(1)操作步骤正确的顺序是(填序号)。
(2)若没有操作④,则所配溶液的浓度会(填“偏高”或“偏低”)。
(3)若所配溶液的密度为1.06 g/mL,则该溶液的质量分数为。
(4)若取出20 mL配好Na2CO3的溶液,加蒸馏水稀释成c(Na+) ="0.01" mol/L的溶液,则稀释后溶液的体积为mL
(5)在配制100 mL、1 mol/L的Na2CO3溶液时,下列操作中的会导致结果偏低(请用序号填写)
①用拖盘天平称量时砝码放在左盘
②将烧杯中的溶液转移到容量瓶时不慎洒到容量瓶外
③定容时俯视刻度线
④定容时仰视刻度线
⑤干净的容量瓶未经干燥就用于配制溶液
现有某金属硝酸盐化学式为M(NO3)2,为了探究其热分解产物,某化学小组开展探究性学习:
[查阅资料]金属活泼性不同,其硝酸盐分解产物不同。如,2KNO3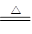 2KNO2+O2↑,
2KNO2+O2↑,
2Cu(NO3)2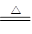 2CuO+2NO2↑+O2↑,4AgNO3
2CuO+2NO2↑+O2↑,4AgNO3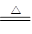 4Ag+4NO2↑+O2↑
4Ag+4NO2↑+O2↑
[提出猜想]猜想1 M(NO3)2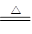 M(NO2)2+O2↑
M(NO2)2+O2↑
猜想2 2 M(NO3)2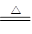 2MO+4NO2↑+O2↑
2MO+4NO2↑+O2↑
猜想3。
[设计实验]为了探究上述猜想,设计如下实验装置: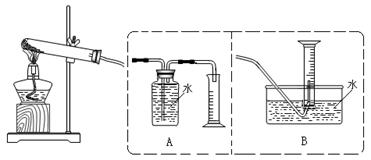
实验步骤:①连接仪器;②检查装置气密性;③取一定量样品装于大试管,并重新连接好仪器;④加热;⑤……
(1)写出猜想3的化学方程式:;
(2)测定气体体积应选择(填A或B);不选另一个装置的理由是;
(3)实验收集到一定量气体,为了检验收集气体的成分,其操作方法是;
(4)在实验后的水里加入适量碳酸氢钠粉末,溶液中产生大量气体,说明正确(填:猜想1.猜想2或猜想3);
(5)该小组测得两组数据:①实验前样品质量为Wg,收集到气体体积为V L;
②实验前样品质量为Wg,完全分解后测得固体产物质量为m g;
请你选择其中一组数据,计算M的相对原子质量为。