世界环保联盟建议全面禁止使用氯气用于饮用水的消毒,而建议采用高效“绿色”消毒剂二氧化氯。二氧化氯是一种极易爆炸的强氧化性气体,易溶于水、不稳定、呈黄绿色,在生产和使用时必须尽量用稀有气体进行稀释,同时需要避免光照、震动或加热。实验室以电解法制备ClO2的流程如下: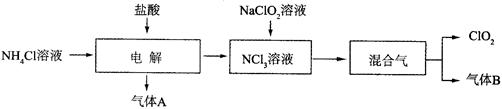
已知:①NCl3是黄色黏稠状液体或斜方形晶体,极易爆炸,有类似氯气的刺激性气味,自然爆炸点为95℃,在热水中易分解,在空气中易挥发,不稳定。
②气体B能使湿润的红色石蕊试纸变蓝。
回答下列问题:
(1)电解时,发生反应的化学方程式为 。
实验室制备气体B的化学方程式为 ,为保证实验的安全,在电解时需注意的问题是:①控制好生成NCl3的浓度;② 。
(2)NCl3与NaClO2(亚氯酸钠)按物质的量之比为1∶6混合,在溶液中恰好反应生成ClO2,该反应的离子方程式为 。
(3)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:准确量取ClO2溶液10 mL,稀释成100 mL试样;
步骤2:量取V1 mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇匀,在暗处静置30 min。
步骤3:以淀粉溶液作指示剂,用c mol/L Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。
(已知I2+2S2O32-=2I-+S4O62-)
①上述步骤3中滴定终点的现象是 ;
②根据上述步骤可计算出原ClO2溶液的浓度为 g /L(用含字母的代数式表示)。
碱金属单质的熔点顺序为Li>Na>K>Rb>Cs,试用金属晶体结构的知识加以解释.
烧过菜的铁锅不及时洗净(残液中含NaCl),第二天会出现红棕色锈斑[该锈斑为Fe(OH)3失水的产物]。试用有关的电极反应式、离子方程式和化学方程式表示Fe(OH)3的生成。
利用以下提供的两个信息:
①乙炔芳构化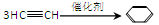
②烃基化反应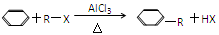 (X为烃基)
(X为烃基)
试以乙炔为原料,无机试剂自选,合成聚苯乙烯。
指出下列聚合反应的类型,并注明其单体。
(1)
(2)
(3)
已知:氯代烃可以与苯在催化剂剂下反应生成氯代苯和氯化氢;苯与浓硫酸作用可以生成苯磺酸。现以十二烷和苯为原料生产对十二烷基苯磺酸钠。写出反应的化学方程式(其它无机原料自选)。