根据表中信息,判断下列叙述中正确的是
| 序号 |
氧化剂 |
还原剂 |
其他反应物 |
氧化产物 |
还原产物 |
| ① |
Cl2 |
FeBr2 |
/ |
|
Cl- |
| ② |
KClO3 |
浓盐酸 |
/ |
Cl2 |
|
| ③ |
KMnO4 |
H2O2 |
H2SO4 |
O2 |
Mn2+ |
A.表中①组的反应只可能有一种元素被氧化和一种元素被还原
B.氧化性强弱的比较: KClO3>Fe3+>Cl2>Br2
C.由表中①②组反应推测:ClO3-、Br-、H+、Fe2+不能在浓溶液中大量共存
D.表中③组反应的离子方程式为:2MnO4-+ 3H2O2 + 6H+=2Mn2+ + 4O2↑+ 6H2O
某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol·L-1的盐酸,测得溶液中的CO2-3、HCO-3、AlO—3、Al3+离子的物质的量与加入盐酸溶液的体积变化关系如图所示,则下列说法正确的是()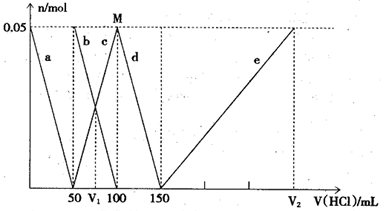
| A.原混合溶液中的CO2-3与AlO—2的物质的量之比为1:2 |
| B.V1:V2=l:5 |
| C.M点时生成的CO2为0.05mol |
| D.a曲线表示的离子方程式为:AlO—2+H++H2O=Al(OH)3↓ |
某矿石由前20号元素中的4种组成,其化学式为WYZX4。X、Y、Z、W分布在三个周期,原子序数依次增大,W、Y为金属元素,X原子的最外层电子数是次外层电子数的3倍,W能与冷水剧烈反应,Y、Z原子的最外层电子数之和与X、W原子的最外层电子数之和相等,Y、Z位于同周期,Z单质是一种良好的半导体。下列说法正确的是()
| A.原子半径:W>Y>Z>X | B.气态氢化物的稳定性:X <Z |
| C.最高价氧化物对应水化物的碱性:Y>W | D.Y、Z的氧化物都有两 性 性 |
已知下列反应的热化学方程式为:C(s)+O2(g)=CO2(g)△H1=—393.5kJ/niol
CH3COOH(1)+2O2(g)= 2CO2(g)+ 2H2O(1)△H2="-" 870.3kJ/mol
H2(g)+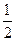 O2(g)=H2O(1)△H="-285.8" kJ/mol
O2(g)=H2O(1)△H="-285.8" kJ/mol
则2C(s)+2H2(g)+O2(g)=CH2COOH(1)的反应热△H为
| A.+488.3kJ/mol | B.-488.3kJ/mol |
| C.-244.15kJ/mol | D.+244.15kJ/mol |
NA表示阿伏加德罗常数的值,下列判断正确的是()
| A.lmol Cu在适量硫蒸气中燃烧,得到的固体质量为80g |
| B.分子数为NA的CO、C2H4的混合气体体积约为22.4L,质量为28g |
| C.56g Fe投入足量冷的浓硝酸中,转移的电子数为3NA |
D.0.lmol1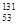 I愿子中含电子数为7.8NA I愿子中含电子数为7.8NA |
分子式为C7H8的某有机物,它能使酸性高锰酸钾溶液褪色,但不能与溴水反应。在一定条件下与H2完全加成,加成后其一氯代物的同分异构体(不考虑立体结构)有()
| A.3种 | B.4种 | C.5种 | D.6种 |