(15分)某研究小组从一含锌废渣(质量百分组成:40.5%ZnO 、19.5%CuO、5.7%FeO、7.3% Fe2O3,其余为SiO2)中回收锌和铜,设计以工业废酸(含15%的H2SO4)为酸浸液的方案,其流程如下图(部分条件略):已知碱式碳酸锌的化学式为Zn(OH)2·ZnCO3。
部分离子以氢氧化物形式开始沉淀和沉淀完全时的pH如下表:
| 离子 |
Fe2+ |
Fe3+ |
Cu2+ |
| 开始沉淀时的pH(初始浓度为1.0 mol/L) |
6.5 |
1.5 |
4.2 |
| 沉淀完全时的pH |
9.7 |
3.2 |
6.7 |
请回答下列问题:
(1)常温下二价锌在水溶液中的存在形式与pH的关系如图,横坐标为溶液的pH,纵坐标为Zn2+ 或Zn(OH)42-(配离子)物质的量浓度的对数(假设Zn2+离子浓度为10-5mol•L-1时,Zn2+离子已沉淀完全).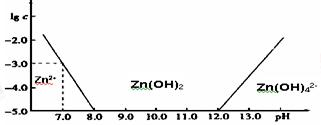
利用图中数据计算,Ksp[Zn(OH)2]= 。
(2)写出试剂a、b的化学式:a: ;b: 。
(3)写出加入H2O2后发生反应的离子反应方程式: 。
(4)写出沉锌过程中的离子反应方程式: ,沉锌后溶液中主要溶质的化学式是 。
(5)将碱式碳酸锌加热分解可得到具有催化性能的活性氧化锌,可用于催化尿素与甲醇合成碳酸二甲酯(DMC)的反应。写出碱式碳酸锌受热分解的化学方程式 。
(6)利用氯化锌溶液与碳酸钠溶液反应制得的碳酸锌中混有碱式碳酸锌,某同学取一定质量的该固体,灼烧至恒重,能否通过固体质量的减少量来确定固体的成分?_______ (填“能”或“否”)
某课外活动小组利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净的氯气与氨气反应的装置。
请回答下列问题:
(1)装置F中发生反应的离子方程式______________________________。
(2)装置A中烧瓶内固体可以选用__________(选填以下选项的代号)。
A.碱石灰 B.生石灰C.二氧化硅 D.氯化钙
(3)上图A—F是按正确实验装置顺序排列的。虚线框内应添加必要的除杂装置,请从上图的备选装置中选择,并将编号填入下列空格:
B__________,D__________,E__________。
(4)C装置的反应原理可应用在检查输送氯气的管道是否漏气,写出检查输送氯气的管道是否漏气的化学方程式_______________________。请设计一个实验方案检验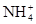 :
:
__________________________________________________________________。
若从装置C的G处逸出的尾气中含有少量Cl2,写出尾气处理的离子方程式:_____________________________________________________________。
. 下列实验操作或对实验事实的描述不正确的是(填序号)
①分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
②向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,以制备Fe(OH)3胶体
③石油的分馏实验中,需将温度计的水银球插入液面以下以控制液体温度
④用瓷坩埚熔化各种钠的化合物
⑤测溶液大致的pH:用玻璃棒蘸取溶液滴在湿润的pH试纸上,与标准比色卡对照
⑥向NaOH溶液中滴加Al2(SO4)3溶液和向Al2(SO4)3溶液中滴加NaOH溶液现象不同
⑦可用饱和碳酸氢钠溶液除去二氧化碳中混有的少量二氧化硫
海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如下:
(1)指出提取碘的过程中有关的实验操作名称:①②、;
(2)从碘水中提取碘所加的有机溶剂可以是(填写化学式),经过操作②后,有机溶剂在(填“上”或“下”)层,呈色。
(3)从含碘的有机溶液中提取碘和回收有机溶剂还需经过蒸馏,指出下图装置中仪器的名称:
A仪器的名称是,
B仪器的名称是。
(4)指出上图实验装置中的错误之处:
①
②
实验室里需要纯净的氯化钠溶液,但只有混有硫酸钠、碳酸氢铵的氯化钠固体。某学生设计了如下方案: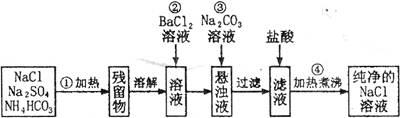
请根据操作流程回答下列问题:
(1)操作 ① 在加热时可选择仪器盛装混合物。
(2)操作 ② 是否可改为加硝酸钡溶液?为什么?。
(3)进行操作 ② 后,如何判断SO42-已沉淀完全?。
(4)操作 ③ 的目的是。
(5)操作 ④ 的目的是。
(18分,每小题2分)用质量分数为98%,密度为1.84g/cm3的浓硫酸来配置500ml,0.2mol/L的稀硫酸。可供选择①玻璃棒②烧瓶③烧杯④胶头滴管⑤量筒⑥容量瓶⑦托盘天平⑧药匙.请回答下列问题:
(1)上述仪器中,在配制稀硫酸时用不到的有(填代号).
(2)经计算,需浓硫酸的体积为mL(保留一位小数);。
(3)将浓硫酸加适量蒸馏水稀释后,冷却片刻,随后全部转移到mL的容量瓶中,转移时应用玻璃棒.转移完毕,用少量蒸馏水洗涤2~3次,并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,振荡容量瓶,使溶液混合均匀.然后缓缓地把蒸馏水直接注入容量瓶直到液面接近瓶颈刻度cm处,改用滴加蒸馏水,使.塞上瓶塞、摇匀后,把溶液倒入试剂瓶、贴上标签.
(4)定容时,俯视刻度线,所配溶液的物质的量浓度将(选填“偏高”、“偏低”或“不变”)