(17分)运用化学反应原理研究碳、氮、硫元素及其化合物有重要意义。
(1)已知一定量的C单质能在O2(g)中燃烧,其可能的产物及能量关系如图所示: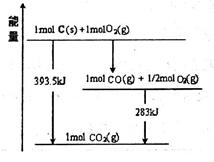
写出CO2(g)与C(s)反应生成CO(g)的热化学方程式_______________________。
(2)汽车尾气净化过程中发生反应2NO(g)+2CO(g) N2+2CO2(g) △H<0。一定条件下,向某密闭恒容容器中按体积比1:l充入44.8L(标准状况)NO和CO混合气体,发生上述反应,某同学根据反应过程中的有关数据绘制了如图所示曲线。
N2+2CO2(g) △H<0。一定条件下,向某密闭恒容容器中按体积比1:l充入44.8L(标准状况)NO和CO混合气体,发生上述反应,某同学根据反应过程中的有关数据绘制了如图所示曲线。
①下列关于上述反应过程的叙述正确的是 ________(填写字母代号)。
| A.其它条件不变,加入催化剂,△H的值不变 |
| B.及时除去二氧化碳,反应的正反应速率加快 |
| C.NO、CO、N2、CO2浓度均不再变化,说明平衡未发生移动 |
| D.混合气体的平均相对分子质量不再改变,证明反应达到化学平衡状态 |
②前10min内CO的平均反应速率为______,达平衡时NO的转化率为_____,能使上述平衡体系中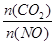 增大的措施有__________(任写一条)。
增大的措施有__________(任写一条)。
(3)已知弱电解质在水中的电离平衡常数(25℃)如下表(单位省略):
| 弱电解质 |
H2CO3 |
H2SO3 |
NH3·H2O |
| 电离平衡常数 |
Ka1=4.2×10-7 Ka2=5.6×10-11 |
Ka1=1.54×10-2 Ka2=1.02×10-7 |
Kb=1.7×10-5 |
①室温条件下。用敞口容器加热氨水一段时间,恢复至室温后,溶液中水的电离程度比加热前_______(填写“增大”、“减小”或“不变”)了.
②常温下,0.1 mo1·L-1(NH4)2SO4溶液呈_____(填“酸”、“中”、“碱”)性。
③常温下,测得某碳酸饮料的pH=6,则该饮料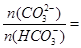 ________。
________。
海洋是一个巨大的化学资源宝库,下图是海水加工的示意图:
(1)海水淡化工厂通常采用的制备淡水的方法有 (写出两种)。
(2)下图是从浓缩海水中提取溴的流程图。写出下图中试剂A的化学式 , 溶液中发生反应的化学方程式为 。
溶液中发生反应的化学方程式为 。
(3)制备金属镁是通过电解熔融的 ,而不用MgO,其原因是
,而不用MgO,其原因是
。
(4)食盐也是一种重要的化工原料,氯碱工业就是通过电解饱和食盐水来制备NaOH、H2和Cl2。海水中得到的粗盐往往含有一些杂质,必须加入一些化学试剂,使杂质沉淀,处理后的盐水还需进入阳离子交换塔,其原因是 。电解食盐水在离子交换膜电解槽中进行,阳离子交换膜的作用是 。
某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5 的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。
的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。
请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。
若测得该试样所含离子的化学组分及其浓度如下表:
| 离子 |
H+ |
K+ |
Na+ |
NH4+ |
SO42- |
NO3- |
Cl- |
| 浓度/mol·L-1 |
未测定 |
4×10-6 |
6×10-6 |
2×10-5 |
4×10-5 |
3×10-5 |
2×10-5 |
根据表中数据判断试样的pH= 。
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。
已知:H2(g)+1/2O2(g)=H2O(g) △H=-241.8kJ·mol-1
C(s)+1/2O2(g)="CO" (g)△H=-110.5kJ·mol-1
写出焦炭与水蒸气反应的热化学方程式: 。
②洗涤含SO2的烟气。以下物质可作洗涤剂的是 。
A.Ca(OH)2B.Na2CO3C.CaCl2D.NaHSO3
(3)汽车尾气中有NOx和CO的生成及转化
①若1mol空气含0.8molN2和0.2molO2,汽缸中的化学反应式为N2 (g)+O2(g) 2NO(g)△H
2NO(g)△H 0,1300℃时将1mol空气放在密闭容器内反应达到平衡,测得NO为8×10-4mol。计算该温度下的平衡常数K= 。汽车启动后,汽缸温度越高,单位时间内NO排放量越大,其原因是 。
0,1300℃时将1mol空气放在密闭容器内反应达到平衡,测得NO为8×10-4mol。计算该温度下的平衡常数K= 。汽车启动后,汽缸温度越高,单位时间内NO排放量越大,其原因是 。
②目前,在汽车尾气系统中装置催化转化器可减少CO和NOx的污染,其化学反应方程式为 。
③汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO,2CO(g)=2C(s)+O2(g),已知该反应的△H 0,判断该设想能否实现并简述其依据: 。
0,判断该设想能否实现并简述其依据: 。
亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。工业设计生产NaClO2的主要流程如下:
(1)A的化学式是 ,装置III中A在 极区产生。
(2)II中反应的离子方程式是 。
(3)通电电解前,检验III中阴离子的方法和步骤是 。
(4)为防止II中制备的NaClO2被还原成NaCl,应选合适的还原剂,除双氧水外,还可以选择的还原剂是 (填字母编号)。
a.Na2O2 b.FeCl2 c.Na2S
(5)常温时,HClO2的电离平衡常数Ka=1.07 10-2mol·L-1,II中反应所得NaClO2溶液(含少量NaOH)的pH=13,则溶液中
10-2mol·L-1,II中反应所得NaClO2溶液(含少量NaOH)的pH=13,则溶液中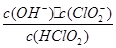 = 。
= 。
(6)气体a、b与氢氧化钠溶液可构成燃料电池,用该电池电解200 mL 0.5 mol·L-1的CuSO4溶液,生成铜3.2 g,此时所得溶液中离子浓度由大到小的顺序是
(本题共16分)
合成氨的原料气H2可通过反应CO(g)+H2O(g)  CO2 (g) +H2(g) 获取。
CO2 (g) +H2(g) 获取。
60.T℃时,向容积固定为5 L的容器中充入1 mol水蒸气和1 mol CO,反应达平衡后,测得CO的浓度为0.08 mol·L-1,则平衡时CO的转化率为 ,该温度下反应的平衡常数K值为 。
61.保持温度仍为T ℃,改变水蒸气和CO的初始物质的量之比,充入固定容器中进行反应,下列描述能够说明体系处于平衡状态的是 (填序号)。
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n (CO) : n (H2O) : n (CO2) : n (H2) = 1 : 16 : 6 : 6
62.液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视。它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。氨在燃烧实验中相关的反应有:
①4NH3(g)+3O2(g)=2N2(g)+6H2O(l)△H1
②4NH3(g)+5O2(g)=4NO(g)+6H2O(l)△H2
③4NH3(g)+6NO(g)=5N2(g)+6H2O(l)△H3
请写出上述三个反应中△H1、△H2、△H3三者之间关系的表达式,△H1= 。
63.美国Simons等科学家发明了使NH3直接用于燃料电池的方法,其装置用铂作为电极、加入碱性电解质溶液,其电池反应为4NH3+3O2=2N2+6H2O
①写出该燃料电池的正极反应式 。
②若用该燃料电池产生的电能在铁皮上镀锌(制白铁皮),某铁皮上现需要镀上9.75g锌,理论上至少需要消耗标准状况的氨气 L。
64.下图是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态)。由图可知Mg与卤素单质的反应均为 (填“放热”或“吸热”)反应。
65.金属Mg与CH3Cl在一定条件下反应可生成CH3MgCl,CH3MgCl是一种重要的有机合成试剂,易与水发生水解反应并有无色无味气体和沉淀生成。写出CH3MgCl水解的化学方程式 。
(本题共11分)
自2010年8月7日,甘肃省舟曲县发生特大泥石流后,各地的救援物资远远不断运往灾区。下图为地方捐助的一种国家准字号补铁补血用药——复方硫酸亚铁叶酸片,其主要成分是绿矾——硫酸亚铁晶体(FeSO4·7H2O)。
某校课外活动小组为测定该补血剂中铁元素的含量特设计实验步骤如下:
请回答下列问题:
54.步骤②中加入过量H2O2的目的是 。
55.步骤③中反应的离子方程式为 。
56.步骤④中一系列处理的操作步骤是:过滤、 、灼烧、 、称量。
57.若实验无损耗,则每片补血剂含铁元素的质量为 g(用含a的代数式表示)。
灾难过后,灾区的饮用水变得非常的浑浊,不能饮用。因此对污染的饮用水的处理成了非常重要的事,其中处理的方法有很多:
58.可以用适量绿矾和氯气一起作用于污染的自来水,而起到较好的净水效果;理由是(用离子方程式表示) ; ;
。
59.在使用过程中发现绿矾和氯气的混合使用对酸性废水中的悬浮物处理效果较差,其原因是 。