(14分)某化学兴趣小组欲验证:“铜和一定量的浓硝酸反应有一氧化氮产生”。设计使用了如下装置进行实验。(假设气体体积均为标准状况,导气管中气体体积忽略不计,且忽略反应中的溶液体积变化)
试回答下列问题:
(1)将铜粉分散在石棉绒中的原因是 ;
(2)在铜和浓硝酸反应前,挤压打气球(球内充满空气),经A、B、C反应后,进入D中的气体主要成分
是 (填化学式),通入该气体的目的是 ;进行此步操作时应关闭 ,打开 (填K1、K2或K3)。
(3)关闭K1、K2,打开K3,由分液漏斗向D中滴加浓硝酸。待Cu和浓硝酸反应结束后,再通过分液漏斗向D中加入CCl4至满。则D中一定发生反应的离子方程式为:____ __________。
(4)若E装置中出现倒吸,可采取的应急操作是 ;
(5)从E装置所得溶液中取出25.00mL,加两滴酚酞,用0.1000 mol·L-1的NaOH溶液滴定,当滴定完成后消耗NaOH溶液18.00mL,若实验测得F装置所收集到的气体体积为139.00 mL,则铜和一定量的浓硝酸反应 (填“有”或“无”)NO生成。
用A、B、C三种装置都可制取溴苯,请仔细分析三套装置,然后回答下列问题:
(1)写出三个装置中都发生反应的化学方程式 、 ;写出B试管中发生反应的化学方程式 。
(2)装置A、C中长导管的作用是 。
(3)B、C装置已连接好,并进行了气密性检验,也装入了合适的药品,接下来要使反应开始,对B应进行的操作是 ,
对C应进行的操作是 。
(4)A中存在加装药品和及时密封的矛盾,因而在实验中易造成的不良后果是 。
(5)B中采用了双球吸收管,其作用是 ;反应后双球管中可能出现的现象是 ;双球管内液体不能太多,原因是 。
(6)B装置也存在两个明显的缺点,使实验的效果不好或不能正常进行,这两个缺点是 。
为探究苯与溴的取代反应,甲用如图装置Ⅰ进行如下实验:
将一定量的苯和溴放在烧瓶中,同时加入少量铁屑,3~5 min后发现装有AgNO3溶液的锥形瓶中有浅黄色的沉淀生成,即证明苯与溴发生了取代反应。
(1)装置I中①的化学方程式为____________________,___________________。
(2)①中长导管的作用是________________________________________________。
(3)烧瓶中生成的红褐色油状液滴的成分是__________________________,要想得到纯净的产物,可用____________试剂洗涤。洗涤后分离产品应使用的仪器是_______________。
(4)甲做实验时,乙观察到烧瓶中液体沸腾并有红棕色气体从导管中逸出,提出必须先除去红棕色气体,才能验证锥形瓶中的产物,原因是_____________________________。
(5)乙同学设计如图所示装置Ⅱ,并用下列某些试剂完成该实验。可选用的试剂是:苯;液溴;浓硫酸;氢氧化钠溶液;硝酸银溶液;四氯化碳。
a的作用是___________________________________
b中的试剂是_________________________________
比较两套装置,装置Ⅱ的主要优点是:(答出两点即可)
①____________________________________________
②____________________________________________
某活动小组进行实验室制取硝基苯和溴苯的实验,
(1)写出制取硝基苯的化学方程式______________________
写出制取溴苯的化学方程式______________________
(2)两个实验中除苯外,还需选用哪些药品_______________(可以多选)
| A.溴水 |
| B.液溴 |
| C.浓硝酸 |
| D.稀硝酸 |
E.浓硫酸
F.稀硫酸
G.Fe粉
H.氯化铁
(3)用如图所示装置制取硝基苯时,长玻璃导管的作用是_________。
(4)纯净的溴苯是无色,密度比水大,不溶于水的液体,因溶有溴而呈褐色,可加入_____________溶液洗涤除去其中的溴,写出该溶液除去溴的反应的化学方程式________________________________。
实验室制取硝基苯常用下图装置:
(1)苯的硝化反应是在浓H2SO4和浓HNO3的混合酸中进行的,混酸的添加顺序是先加后加 。
(2)请写出该反应的方程式_______________________________。
(3)被水浴加热的试管口部都要带一长导管,其作用是_____________________________
(4)苯的化学性质是易取代,那么除了苯的硝化反应外,你还能写出其他的取代反应方程式吗?请写出 .
(2012年海南卷)实验室制备1,2-二溴乙烷的反应原理如下:
可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚。
用少量的溴和足量的乙醇制备1,2—二溴乙烷的装置如下图所示: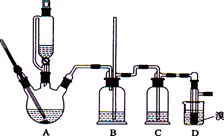
有关数据列表如下:
| 乙醇 |
1,2-二溴乙烷 |
乙醚 |
|
| 状态 |
色液体 |
无色液体 |
无色液体 |
| 密度/g·cm-3 |
0.79 |
2.2 |
0.71 |
| 沸点/℃ |
78.5 |
132 |
34.6 |
| 熔点/℃ |
一l30 |
9 |
-1l6 |
回答下列问题:
(1)在此制各实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是 ;(填正确选项前的字母)
a.引发反应b.加快反应速度
c.防止乙醇挥发d.减少副产物乙醚生成
(2)在装置C中应加入 ,其目的是吸收反应中可能生成的酸性气体 (填正确选项前的字母)
a.水b.浓硫酸
c.氢氧化钠溶液d.饱和碳酸氢钠溶液
(3)判断该制各反应已经结束的最简单方法是 ;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在 层(填“上”、“下”);
(5)若产物中有少量未反应的Br2,最好用 洗涤除去;(填正确选项前的字母)
a.水b.氢氧化钠溶液c.碘化钠溶液 d.乙醇
(6)若产物中有少量副产物乙醚.可用 的方法除去;
(7)反应过程中应用冷水冷却装置D,其主要目的是 ;但又不能过度冷却(如用冰水),其原因是 。