原子序数依次增大的元素a、b、c、d,它们的最外层电子数分别为1、6、7、1。a-的电子层结构与氦相同,b和c的次外层有8个电子,c-和d+的电子层结构相同。下列叙述错误的是
| A.元素的非金属性次序为c>b>a |
| B.a和其他3种元素均能形成共价化合物 |
| C.d和其他3种元素均能形成离子化合物 |
| D.元素a 、b、c各自最高和最低化合价的代数和分别为0、4、6 |
下表中评价合理的是
| 选项 |
化学反应及其离子方程式 |
评价 |
| A |
Fe3O4与稀硝酸反应: 2Fe3O4+18H+=6Fe3++H2↑+8H2O |
正确 |
| B |
向碳酸镁中加入稀盐酸: CO32-+2H+=CO2↑+H2O |
错误,碳酸镁不应该写成离子形式 |
| C |
向硫酸铵溶液中加入氢氧化钡溶液: Ba2++SO42-=BaSO4↓ |
正确 |
| D |
FeBr2溶液与等物质的量的Cl2 反应: 反应:2Fe2++2Br-+2Cl2=2Fe3++4Cl-+Br2 |
错误,Fe2+与Br-的化学计量数之比应为1:2 |
X、Y均为元素周期表中前20号元素,其简单离子的电子层结构相同,下列说法正确的是
| A.由mXa+与nYb-得,m+a = n-b |
| B.X2-的还原性一定大于Y- |
| C.X、Y一定不是同周期元素 |
| D.若X的原子半径大于Y,则气态氢化物的稳定性HmX一定大于HnY |
在10 L密闭容器中,1 mol A和3 mol B在一定条件下反应:A(g)+xB(g)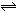 2C(g),2min后反应达到平衡,测得混合气体共3.4 mol,生成0.4 mol C,则下列计算结果不正确的是
2C(g),2min后反应达到平衡,测得混合气体共3.4 mol,生成0.4 mol C,则下列计算结果不正确的是
| A.平衡时,物质的量比A∶B∶C=2∶11∶4 | B.x值等于4 |
| C.A的转化率20% | D.B的平均反应速率为0.4 mol·L-1·min-1 |
可逆反应aA(s)+bB(g) cC(g) +dD(g),△H=Q,反应过程中,当其他条件不变时,某物质在混合物中的含量与温度(T)、压强(p)的关系如图所示据图分析,以下正确的是
cC(g) +dD(g),△H=Q,反应过程中,当其他条件不变时,某物质在混合物中的含量与温度(T)、压强(p)的关系如图所示据图分析,以下正确的是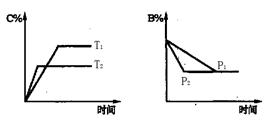
| A.T1>T2,Q>0 | B.Tl<T2,Q<0 |
| C.P1>P2,a+b=c+d | D.Pl<P2,b=c+d |
已知H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是-285.8kJ·mol-1、-1411.0kJ·mol-1和
-1366.8kJ·mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为
| A.-44.2 kJ·mol-1 | B.+44.2 kJ·mol-1 | C.-330 kJ·mol-1 | D.+330 kJ·mol-1 |