将氢氧化钠和氯化钠的混合物19.3g,放入80.7g水中使其完全溶解,再加入100g溶质质量分数为7.3%的稀盐酸,恰好完全反应。试计算:
(1)将上述浓度的稀盐酸100克稀释为溶质质量分数为4%的稀盐酸,需要加入水的质量;
(2)原混合物中氢氧化钠的质量;
(3)反应后所得溶液中溶质的质量。
完成下列研究性学习的有关内容;探究氯酸钾和二氧化锰混合物中二氧化锰的质量分数。(计算结果保留到0.01%)
[研究方案]先称取一定质量的氯酸钾和二氧化锰混合物,放入大试管中加热至质量不再变化为止。根据质量守恒定律,固体物质减轻的质量即为产生氧气的质量,从而求出氯酸钾的质量。(学习小组同学事先查阅资料获知,二氧化锰的质量在反应前后不变且在水中难溶)
(1)[解决问题]实验测得固体混合物质量随加热时间变化的相关数据如图所示。请你完成下列问题: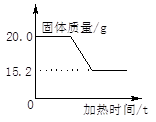
①反应后生成氧气的质量是;
②原混合物中氯酸钾的质量是;
③原混合物中二氧化锰的质量分数是。
(2)[继续研究]为了分离回收二氧化锰和氯化钾,他们在反应后的固体混合物中加入92.55g水使其中的氯化钾完全溶解,然后过滤使二氧化锰与溶液分离。请你计算他们得到的滤液中氯化钾的质量分数。(过滤中水的损失不计)。
化学小组同学欲测定铜锌合金中铜元素的质量分数。
(1)甲方案:取10 g合金粉末,加入少量稀硫酸后,收集到0.1 g氢气,计算合金中铜元素的质量分数为67.5%。老师指出其测定结果不准确,原因是。
(2)乙方案:取10 g合金粉末,加入足量硫酸铜溶液,充分反应后,过滤,洗涤,烘干,测得固体质量为9.9 g。计算合金中铜元素的质量分数。(写出计算过程)
某化学探究小组的同学为测定某样品中铁的质量分数,他们将样品放入烧杯中,再加入足量的稀盐酸,至不再有气泡产生为止.各步称量数据如下:(稀盐酸的挥发可忽略不计)
生铁样品质量为11.5 g ;烧杯的质量 为32.5 g;所加稀盐酸的质量为200.0 g;
反应后烧杯及所盛物质的总质量为243.6 g 请回答下列问题:
(1)反应中产生气体的质量是g.
(2)计算该生铁样品中铁的质量分数(写出计算步骤,计算结果精确到0.1%).
某兴趣小组的同学研究(Cu-Zn合金)样品中锌的含量,取该样品18g跟足量的稀硫酸充分反应,产生氢气的质量与所用稀硫酸的质量关系如下图所示。请计算:
(1)该样品中锌的质量为。
(2)所用稀硫酸的溶质质量分数(要有规范的计算过程)。
(3)图中A点时,反应后所得溶液的溶质质量分数为。(保留1位小数)。
实验室现有固体高锰酸钾31.6g,如忽略加热高锰酸钾时的各种损失,并使其完全受热分解,则最多可制取多少克氧气?
以下是小华与小军对以上问题的两种解题过程,请你仔细观察该解题过程,并回答其后的问题。
(1)小华同学的解法是错误的,理由是。
(2)小军同学的解法除了格式错误外,其最主要错误是。
(3)请你写出该题正确的完整的解题过程。