下列各组数据中比值不为1:1的是
| A.100℃时,pH=6的纯水中,c(OH-)与c(H+)之比 |
B.常温下,pH=1的HF溶液与 的盐酸中 的盐酸中 之比 之比 |
| C.常温下,pH=7的CH3COOH与CH3COONa的混合溶液中,c(CH3COO-)与c(Na+)之比 |
| D.常温下,pH=12的Ba(OH)2溶液与pH=12的KOH溶液中溶质的物质的量浓度之比 |
科学的假设与猜想是科学探究的前提,下列探究肯定没有意义的是
| A.探究SO2和Na2O2反应可能有Na2SO4生成 |
| B.探究Na与水的反应生成的气体可能是O2 |
| C.探究浓硫酸与铜在一定条件下反应产生的黑色物质可能是CuS |
| D.探究向滴有酚酞试液的NaOH溶液中通入Cl2,酚酞红色褪去的原因是溶液的酸碱性改变所致,还是HClO的漂白性 |
泡沫灭火器内装的药液之一是NaHCO3饱和溶液,而不选用更廉价的Na2CO3饱和溶液,其原因是
①质量相同的两种钠盐,NaHCO3与足量酸反应产生的CO2比Na2CO3多
②产生相同体积(同温、同压)的CO2,消耗的物质的量NaHCO3比Na2CO3少
③NaHCO3与酸反应比Na2CO3快得多
④NaHCO3比Na2CO3稳定,便于长期保存
| A.只有①③ | B.只有②③ | C.①②③ | D.①②③④ |
三氟化氮(NF3)是微电子工业中一种优良的等离子蚀刻气体。在潮湿的空气中能发生下列反应:3NF3+5H2O=2NO+HNO3+9HF。下列有关判断正确的是
| A.反应中NF3是氧化剂,H2O是还原剂 |
| B.反应中被氧化与被还原的原子物质的量之比为2∶1 |
| C.若反应中生成0.2mol HNO3,则反应共转移0.4mol电子 |
| D.NF3在潮湿空气中泄漏会产生红棕色气体 |
一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体VL(标准状况),同时生成Cu2+和SO42-。向反应后的溶液中加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO12.0g,若上述气体为NO和NO2的混合物,且体积比为1﹕1,则V可能为
| A.8.0L | B.10.5L | C.15.7L | D.16.8L |
下列各组物质中,满足表中图示物质一步转化关系的组合有
| 序号 |
X |
Y |
Z |
W |
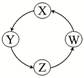 |
| ① |
Na |
NaOH |
Na2CO3 |
NaCl |
|
| ② |
Al |
NaAlO2 |
Al(OH)3 |
Al2O3 |
|
| ③ |
SO2 |
S |
SO3 |
H2SO4 |
|
| ④ |
NH3 |
NO |
NO2 |
HNO3 |
A.①② B.①③ C.②③ D.②④