下列关于化学观或化学研究方法的叙述中,错误的是
| A.在化工生产中应遵循“绿色化学”的思想 |
| B.在过渡元素中寻找优良的催化剂 |
| C.在元素周期表的金属和非金属分界线附近寻找半导体材料 |
D.根据元素周期律,由HClO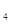 可以类推出氟元素也存在最高价氧化物的水化物HFO 可以类推出氟元素也存在最高价氧化物的水化物HFO |
已知在酸性溶液中,下列物质氧化KI时,自身发生如下变化:
Fe3+→Fe2+;MnO4-→Mn2+;Cl2→2Cl-;HNO3→NO。 如果分别用相同物质的量的这些物质氧化足量的KI,得到I2最多的是
| A.Fe3+ | B.MnO4- | C.Cl2 | D.HNO3 |
将SO2通人BaCl2溶液中至饱和未见有沉淀生成,继续通入另一气体,仍无沉淀生成,则该气体可能为
| A.NO2 | B.NH3 | C.Cl2 | D.HI |
下列各组离子在溶液中可以大量共存的是
| A.K+、Na+、ClO—、H+ | B.Fe2+、NO3—、Cl—、Na+ |
| C.Al3+、Mg2+、NO3—、OH— | D.H+、K+、Cl—、SiO32— |
能与SO2气体发生反应且有沉淀产生的是
①NaOH溶液 ②H2S溶液 ③Ba (NO3)2酸性溶液 ④CaCl2和氨水的混合液
| A.①②③ | B.②③④ | C.全部 | D.①③④ |
将5mL0.4mol/LAgNO3溶液与10 mL 0.3mol/LBaCl2溶液混合,反应后,溶液中离子浓度最大的是
| A.Ag+ | B.NO3- | C.Ba2+ | D.Cl- |