根据元素周期表和元素周期律,下列推断正确的是
| A.HF、HCl、HBr、HI的酸性逐渐增强,说明F、Cl、Br、I的非金属性逐渐增强 |
| B.元素R最高正价为+7价,表明R元素一定是ⅦA族元素 |
| C.从元素在周期表中的位置可以推断,硅和锗都可用作半导体材料 |
| D.若M+和R2-具有相同的电子层结构,则原子半径:M<R |
实验室将NaClO3和Na2SO3按物质的量之比1∶2倒入烧瓶中,用水浴加热,同时滴入H2SO4,产生气体X,反应后测得NaClO3和Na2SO3恰好完全反应,则X为
| A.Cl2 | B.Cl2O | C.ClO2 | D.Cl2O3 |
常温下,在溶液中可发生以下反应:① H++Z-+XO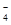 === X2++Z2+H2O(未配平),
=== X2++Z2+H2O(未配平),
② 2M2++R2===2M3++2R-,③ 2R-+Z2=== R2+2Z-。由此判断下列说法正确的是
| A.常温下反应2M2++Z2===2M3++2Z-不可以自发进行 |
| B.R元素在反应②中被氧化,在③中被还原 |
| C.反应①配平后,H2O的化学计量数为8 |
| D.还原性强弱顺序为:X2+>Z->R->M2+ |
下列离子组在一定条件下能共存,当加入相应试剂后会发生化学变化,且所给离子方程式正确的是
| 选项 |
离子组 |
加入试剂 |
加入试剂后发生反应的离子方程式 |
| A |
Fe2+、NO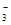 、K+ 、K+ |
稀硫酸 |
3Fe 2++NO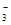 +4H+===3Fe3++NO↑+2H2O +4H+===3Fe3++NO↑+2H2O |
| B |
Fe3+、I-、ClO- |
氢氧化钠溶液 |
Fe3++3OH-===Fe(OH)3↓ |
| C |
Ba2+、HCO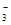 、Cl- 、Cl- |
氢氧化钠溶液 |
HCO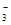 +OH-===CO +OH-===CO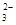 +H2O +H2O |
| D |
Al3+、Cl-、NO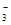 |
过量氢氧化钠溶液 |
Al3++3OH-===Al(OH)3↓ |
在下述条件下,一定能大量共存的离子组是
A.无色透明的水溶液中:K+、Ba2+、I-、MnO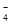 |
B.含有大量NO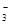 的水溶液中:NH 的水溶液中:NH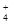 、Fe2+、SO 、Fe2+、SO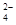 、H+ 、H+ |
C.C(HCO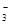 )=0.1 mol·L-1的溶液中:Na+、K+、CO )=0.1 mol·L-1的溶液中:Na+、K+、CO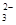 、Br- 、Br- |
D.强碱性溶液中:ClO-、S2-、HSO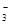 、Na+ 、Na+ |
下列实验设计及其对应的离子方程式均正确的是
| A.用FeCl3溶液腐蚀铜线路板:Cu + 2Fe3+= Cu2+ + 2Fe2+ |
| B.Na2O2与H2O反应制备O2:Na2O2 + H2O= 2Na+ + 2OH- + O2↑ |
| C.将氯气溶于水制备次氯酸:Cl2 + H2O= 2H+ + Cl- + ClO- |
D.用惰性电极电解饱和氯化钠溶液:2Cl- + 2H+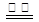 H2↑+ Cl2↑ H2↑+ Cl2↑ |