下列热化学方程式中,正确的是
| A.甲烷的燃烧热为 890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3 kJ/mol |
B.500℃、30MPa 下,将 0.5mol N2(g)和 1.5molH2(g)置于密闭容器中充分反应生成 NH3(g)放热 19.3 kJ,其热化学方程式为:N2(g)+3H2(g)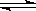 2NH3(g) △H=-38.6 kJ/mol 2NH3(g) △H=-38.6 kJ/mol |
| C.HCl 和NaOH 反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol |
| D.在 101 kPa 时,2gH2完全燃烧生成液态水,放出 285.8kJ 热量,氢气燃烧的热化学方程式表示为 2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJ/mol |
在酸性溶液中,能大量共存的离子组是
| A.K+、NH4+、NO3-、SO42- | B.K+、Na+、Cl-、SO32- |
| C.Fe2+、Na+、NO3-、Cl- | D.K+、NH4+、OH-、SO42- |
下列离子反应方程式书写正确的是
| A.FeCl2溶液中通入Cl2:Fe2+ +Cl2 ="==" Fe3+ + 2Cl- |
| B.实验室用固体氯化铵和熟石灰共热制取NH3: 2NH4++Ca(OH)2 ="==" 2NH3↑+ Ca2++H2O |
| C.FeO与稀HNO3反应:3FeO + 10H+ + NO3- ="==" 3Fe3+ + NO↑+5H2O |
| D.实验室用石灰石制CO2:CO32- + 2H+ ="==" CO2↑+ H2O |
下列除杂的操作方法,正确的是
| A.NH3中混有少量水蒸气:通过装有浓硫酸的洗气瓶 |
| B.NO中混有少量NO2气体:用水洗涤后再干燥 |
| C.食盐中混有少量NH4Cl:加过量烧碱溶液后加热蒸干 |
| D.硝酸混有少量硫酸:加适量BaCl2后再过滤 |
氨水显弱碱性的主要原因是
| A.通常状况下,氨的溶解度不大 | B.氨水中的NH3·H2O电离出少量OH-[ |
| C.溶于水的氨分子只有少量电离 | D.氨本身的弱碱性 |
工业上采用接触法制硫酸,其中在接触室进行的反应是
A.S + O2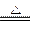 SO2 SO2 |
B.4FeS2 + 11O2 2Fe2O3 + 8SO2 2Fe2O3 + 8SO2 |
C.2SO2 + O2 2SO3 2SO3 |
D.SO3 + H2O = H2SO4 |