已知:25 ℃时,Ksp[Mg(OH)2] = 5.61×10-12,Ksp(MgF2)= 7.42×10-11。下列说法正确的是
| A.25 ℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大 |
| B.25 ℃时,在Mg(OH)2的悬浊液加入少量的NH4Cl固体,c(Mg2+)增大 |
| C.25 ℃时,Mg(OH)2固体在20 mL 0.01 mol/L氨水中的Ksp比在20 mL 0.01 mol/L NH4Cl溶液中的Ksp小 |
| D.25 ℃时,在Mg(OH)2的悬浊液加入NaF溶液后,Mg(OH)2不可能转化成为MgF2 |
2 mol A与2 mol B混合于2 L的密闭容器中,发生反应:2A(g)+3B(g)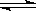 2C(g)+zD(g),若2 s后,A的转化率为50%,测得v(D)=0.25 mol·L-1·s-1,下列推断正确的是
2C(g)+zD(g),若2 s后,A的转化率为50%,测得v(D)=0.25 mol·L-1·s-1,下列推断正确的是
A.v(C)=0.2 mol·L-1·s-1
B.z=3
C.B的转化率为25%
D.C平衡时的浓度为0.5 mol·L-1
下列有关化学反应速率的说法中,正确的是
| A.100 mL 2 mol/L盐酸与锌反应时,加入100 mL氯化钠溶液,生成氢气的速率不变 |
B.对于可逆反应2CO+2NO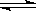 N2+2CO2,使用合适的催化剂,CO的生成速率和消耗速率都加快 N2+2CO2,使用合适的催化剂,CO的生成速率和消耗速率都加快 |
| C.二氧化硫的催化氧化是一个放热反应,升高温度,正反应速率减慢 |
| D.用铁片和稀硫酸反应制取氢气时,改用铁片和浓硫酸可以加快氢气的产生 |
微型纽扣电池在现代生活中是广泛应用的一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,电极反应式分别为:Zn+2OH--2e-===ZnO+H2O,Ag2O+H2O+2e-===2Ag+2OH-,电池总反应式为Ag2O+Zn===2Ag+ZnO。根据上述反应式,判断下列叙述中正确的是
| A.在使用过程中,电池负极区溶液pH增大 |
| B.在使用过程中,电子由Ag2O极经外电路流向Zn极 |
| C.在使用过程中,Zn电极发生还原反应,Ag2O电极发生氧化反应 |
| D.外电路中每通过0.2 mol电子,正极的质量理论上减小1.6 g |
在如图所示的8个装置中,属于原电池的是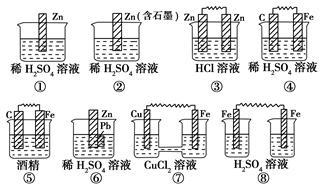
| A.①④ | B.③④⑤ | C.④⑧ | D.②④⑥⑦ |
航天飞船可用肼(N2H4)作动力源。已知1 g液态肼和足量的液态过氧化氢反应生成N2和水蒸气时放出20.05 kJ热量,化学方程式如下:N2H4+2H2O2===N2↑+4H2O。下列说法中错误的是
| A.该反应中肼作还原剂 |
| B.此情况下,液态肼燃烧生成1 mol N2时放出的热量为641.6 kJ |
| C.肼(N2H4)分子中只存在极性共价键 |
| D.该反应的反应物总能量高于生成物的总能量 |