A、B、C、D、E、F六种元素分布在三个不同的短周期,它们的原子序数依次增大,其中B与C为同一周期,D与F为同一周期,A与D、C与F分别为同一主族,C元素的原子最外层电子数是次外层电子数的三倍,D是所在周期原子半径最大的元素。又知六种元素所形成的常见单质在常温压下有三种是气体,三种是固体。
请回答下列问题:
(1)工业上用A和B的单质化合制备化合物X,该反应的化学方程式 。
(2)若E是非金属元素,其单质在电子工业中有重要应用,请写出其氧化物溶于强碱溶液的离子方程式: 。
(3)若D、E、F的最高价氧化物的水化物两两能发生反应,则E的最高价氧化物的水化物与D的最高价氧化物的水化物反应的离子方程式 。
(4)用电子式表示化合物D2F的形成过程 。
(5)由A、B、C三种元素组成的化合物X中共含有9个原子,X中所含化学键类型有 。
脱羧反应形成新的C-C键为有机合成提供了一条新的途径,例如: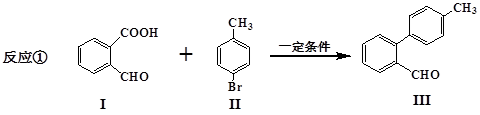
(1)化合物I的分子式为_________,化合物I含有的官能团名称是______________,
(2)化合物III与新制氢氧化铜反应的化学方程式为________________________。
(3)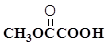 与
与 也可以发生类似反应①的反应,有机产物的结构简式为:_________________________。
也可以发生类似反应①的反应,有机产物的结构简式为:_________________________。
(4)化合物I有多种同分异构体,请写出任意2种符合下列条件的同分异构体的结构简式:___________。(要求:①能与FeCl3溶液发生显色反应;②苯环上一氯取代产物有2种)
(12分)对二甲苯(英文名称p-xylene,缩写为PX)是一种低毒化合物,也是聚酯工业的重要原料,主要用于生产对苯二甲酸(PTA),对苯二甲酸再和乙二醇(EG)反应生成聚对苯二甲酸乙二醇酯(PET)。国内对二甲苯产量增长步伐放缓,供应缺口加大,近一半的PX依靠进口。以PX为主要原料生产PET的一种路线如下: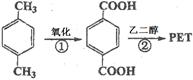
(1)PX可以发生的反应类型有加成反应、、。(填反应类型)
(2)PX的核磁共振氢谱有组峰,峰面积之比为。
(3)反应②的化学方程式为。(不用注明条件)
(4)PX的来源之一是煤的干馏。已知煤干馏副产物煤焦油主要成分有苯、甲苯、混合二甲苯、酚类等,从煤焦油中分离提纯对二甲苯的方法是。
(5)“甲苯甲醇烷基化”制备对二甲苯是一条增产PX的新工艺路线: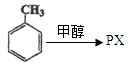
写出该反应的化学方程式:。(不用注明条件)
(6)PTA的一种同分异构体X与其含有相同官能团,且其苯环上的一氯取代物有两种,写出化合物X 与1,3-丙二醇1:1形成最简单环酯的结构简式:。
PNA是一种具有良好的热稳定性、耐腐蚀性和抗水性的高分子化合物,常用作塑化剂,其合成路线如下图所示: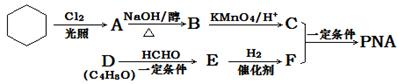
已知:①R1CH=CHR2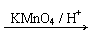 R1COOH + R2COOH (R1、R2代表烃基)
R1COOH + R2COOH (R1、R2代表烃基)
②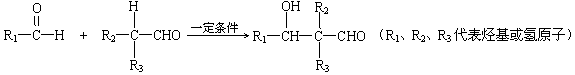
请回答:
(1)E→F的反应类型是。
(2)C含有的官能团名称是。
(3)A分子中只有一个氯原子,A→B的化学方程式是。(注明反应条件)
(4)D能发生银镜反应,且分子中有支链,D的结构简式是。
(5)E的结构简式是。
(6)C与F在一定条件下生成增塑剂PNA的反应的化学方程式是:。(不用注明反应条件)
已知A和B两只试管的溶液中含有K+、Ag+、Mg2+、Cl-、NO3-、OH-六种离子,向A试管中滴加酚酞溶液呈红色。请回答下列问题:
(1)A试管的溶液中含有上述离子有__________;若向A溶液中加入铝片写出该化学反应的离子方程式______________________________________________________________________;
(2)向某试管中滴加稀盐酸产生白色沉淀,则该试管为____________(填A或B);
(3)若将试管A和试管B的溶液按一定的体积比混合过滤后,蒸干可得到—种纯净物,则混合过程中发生反应的离子方程式______________、___________;
(4)若向试管A的溶液中的阳离子组成的碳酸氢盐溶液中,分别滴加盐酸和少量Ba(OH)2,则反应的离子方程式分别为_______________________、_____________________________________。
已知将盐酸滴入高锰酸钾溶液中,产生黄绿色气体(Cl2),而溶液的紫红色褪去。现有一个氧化还原反应的体系中,共有KCl、Cl2、H2SO4、H2O、KMnO4、MnSO4、K2SO4七种物质:
(1)该反应中,化合价升高的反应物是__________,化合价没有发生变化的反应物是_____________。
(2)该反应中,发生还原反应的过程是(填化学式)___________→____________。
(3)上述反应中,1 mol氧化剂在反应中______(填“得到”或“失去”)______mol电子。
(4)如果在反应后的溶液中加入NaBiO3,溶液又变紫红色,说出NaBiO3的一个化学性质:。