(8分,多选错选不得分)现有下列物质, 用编号填空回答下列问题:
A.干冰
B.金刚石
C.氦
D.过氧化钠
E.二氧化硅
F.氯化铵
(1)通过非极性键形成的原子晶体是: 。
(2)可由原子直接构成的晶体是: 。
(3)含有离子键、共价键、配位键的化合物是: 。
(4)含有非极性键的离子化合物是: 。
(5)已知微粒间的作用力包括离子键、共价键、金属键、范德华力、氢键 。氯化钠熔化,粒子间克服的作用力为____________;二氧化硅熔化,粒子间克服的作用力为____________;干冰气化,粒子间克服的作用力为____________。A、B、C、D四种物质的熔点从低到高的顺序为____________________(填序号)。
四种短周期元素的性质或结构信息如下表。请根据信息回答下列问题。
| 元素 |
T |
X |
Y |
Z |
| 性质 结构 信息 |
人体内含量最多的元素,且其单质是常见的助燃剂。 |
单质为双原子分子,分子中含有3对共用电子对,常温下单质气体性质稳定,但其原子较活泼。 |
单质质软、银白色固体、导电性强。 单质在空气中燃烧发出黄色的火焰。 |
第三周期元素的简单离子中半径最小 |
(1)写出元素T的离子结构示意图;写出元素X的气态氢化物的电子式;离子半径比较:Y离子Z离子(填“>”或“<”)。
(2)写出Z原子的核外电子排布式。
(3)Z的最高价氧化物对应水化物的电离方程式。
(4)元素T与氟元素相比,非金属性较强的是(用元素符号表示),下列表述中能证明这一事实的是
a.常温下氟气的颜色比T单质的颜色深
b.氟气与T的氢化物剧烈反应,产生T的单质
c.氟与T形成的化合物中T元素呈正价态
d.比较两元素的单质与氢气化合时得电子的数目
二氧化硫和氮氧化物(NOx)对大气污染日趋严重,研究消除大气污染的方法是化学工作者的重要课题,目前有很多种方法消除大气污染。
(1)可利用甲烷催化还原NOx的方法处理NOx,反应如下:
CH4(g)+4NO2(g)= 4NO(g)+CO2(g)+2H2O(g);△H= -574 kJ·mol-1
CH4(g)+4NO(g)= 2N2(g)+CO2(g)+2H2O(g);△H= -1160 kJ·mol-1
则CH4(g)+2NO2(g)= N2(g)+CO2(g)+2H2O(g);△H=;
(2)降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:2NO(g)+2CO(g) N2(g)+2CO2(g);△H<0。
N2(g)+2CO2(g);△H<0。
若在一定温度下,将2molNO、1molCO充入1L固定容积的容器中,15分钟后达到平衡,反应过程中各物质的浓度变化如图甲所示,则平衡常数K=(小数点后保留3位);
①若保持温度不变,20min时再向容器中充入CO气体0.6mol,平衡将移动(填“向左”、“向右”或“不”);
②若保持温度不变,20min时向原平衡容器中充入CO、N2各0.6mol,平衡将移动(填“向左”、“向右”或“不”);
③20min时,若改变反应条件,导致N2浓度发生如图所示的变化,则改变的条件可能是
(填字母);
| A.加入催化剂 | B.降低温度 | C.缩小容器体积 | D.增加CO2的量 |
(3)利用Fe2+、Fe3+的催化作用,常温下将SO2转化为SO42-,从而实现对SO2的处理(总反应为2SO2+O2+2H2O=2H2SO4)。已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ =4Fe3+ + 2H2O,则另一反应的离子方程式为;
下面a~e是中学化学实验中常见的几种定量仪器:
(a)量筒(b)容量瓶(c)滴定管 (d)托盘天平 (e)温度计
(1)无“0”刻度的是(填写编号)。
(2)下列操作合理的是(填字母)
| A.用25mL碱式滴定管量取20.00mLNaHCO3 |
| B.用托盘天平准确称量10.20克碳酸钠固体 |
| C.用100mL量筒量取3.2mL浓硫酸 |
| D.配制1 mol·L–1的氢氧化钠溶液475mL选用500mL容量瓶 |
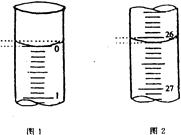
(3)某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,若滴定开始和结束时,酸式滴定管中的液面如上图所示:则所用盐酸溶液的体积为mL。
(4)图甲表示10 mL量筒中液面的位置,A与B,B与C刻度间相差1 mL,如果刻度A为4,量筒中液体的体积为mL;图乙表示25 mL酸式滴定管中某酸的体积,D与E 之间的刻度差为1 mL,如果刻度D为4,则该酸式滴定管中液体体积的读数为mL。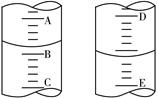
图甲图乙
(1)25℃时,某NaCl溶液中c(Cl–)=1×10-4 mol·L–1,则该溶液中c(Na+)∶c(OH-)=
(2)25℃时,将0.1 mol·L–1NaOH溶液与0.06 mol·L–1的H2SO4溶液等体积混合(忽略混合后体积的变化),求所得溶液的pH=。25℃时,pH值为8的NaOH溶液与pH值为10的NaOH溶液等体积混合后,溶液中氢离子浓度最接近。
(3)25℃时,下列四种溶液中,①pH=0的盐酸②0.1 mol·L–1的盐酸③0.01 mol·L–1的NaOH溶液④pH=11的NaOH溶液,由水电离生成氢离子浓度之比①︰②︰③︰④是:(填字母)
| A.1︰10︰100︰1000 | B.0︰1︰12︰11 |
| C.14︰13︰12︰11 | D.14︰13︰2︰3 |
(4)某温度(t℃)时,测得0.01mol·L-1的NaOH溶液的pH=11,
①则该温度下水的Kw= 。
②在该温度下测得某溶液pH=3,则该溶液中c(H+)∶c(OH-)=________。
③该温度下将pH=2的盐酸和pH=11的氢氧化钠溶液等体积混合,pH=______________
(5) 纯水中c(H+)=5.0×10–7 mol·L–1,则此时纯水中的c(OH–) =;若温度不变,滴入稀硫酸使c(H+)=5.0×10–3 mol·L–1,则c(OH–) =;在该温度时,往水中滴入NaOH溶液,溶液中的c(OH–)=5.0×10–2 mol·L–1,则溶液中c(H+)=。
在一定温度下,有盐酸、硫酸、醋酸三种溶液,请按要求回答下列问题:
(1)当三种酸的物质的量浓度相同时,电离出来的c(H+)最大的是__________。
(2)若三者电离出来的c(H+)相同时,三种酸的物质的量浓度最小的是________。
(3)pH相同、体积相同的醋酸溶液和盐酸分别与足量的锌反应,刚开始反应时的反应速率的大小关系为______(填“相等”或者“不等”),相同状况下产生氢气的体积最大的酸是______。pH相同的醋酸溶液和盐酸,分别用蒸馏水稀释至原体积的m倍和n倍,稀释后两溶液pH仍相同,则m和n的关系是:mn(填“>”、“=”、“<”)
(4)同体积、同物质的量浓度的醋酸和盐酸两种酸,分别中和同浓度的NaOH溶液,消耗NaOH的体积大小关系为(填“相等”或者“不等”)