已知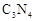 晶体具有比金刚石还大的硬度,且构成该晶体的微粒间只以单键结合。下列关于
晶体具有比金刚石还大的硬度,且构成该晶体的微粒间只以单键结合。下列关于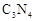 晶体说法错误的是
晶体说法错误的是
| A.该晶体属于原子晶体,其化学键比金刚石更牢固 |
| B.该晶体中每个碳原子连接4个氮原子、每个氮原子连接3个碳原子 |
| C.该晶体中碳原子和氮原子的最外层都满足8电子结构 |
| D.该晶体与金刚石相似,原子间都是非极性键 |
用3g块状大理石与30mL 3mol/L盐酸反应制取CO2气体,若要增大反应速率,可采取的措施是( )
①再加入30mL 3mol/L盐酸 ②改用30mL 6mol/L盐酸 ③改用3g粉末状大理石 ④适当升高温度
| A.①②④ | B.②③④ | C.①③④ | D.①②③ |
下列有关化学键与晶体结构说法正确的是( )
| A.非金属元素组成的化合物一定是共价化合物 |
| B.对于组成结构相似的分子晶体,相对分子质量越大,熔沸点一定越高 |
| C.两种元素组成的分子一定只有极性键 |
| D.含阴离子的化合物一定有阳离子 |
下列反应中生成物总能量高于反应物总能量的是( )
| A.双氧水催化分解 |
| B.乙醇燃烧 |
| C.铝粉与氧化铁粉末反应 |
| D.氯化铵与氢氧化钡晶体反应 |
下列物质中σ键和π键数目比为1 :2的是( )
| A.O2 | B.HCN | C.CO2 | D.N2 |
下列基态原子或离子核外未成对电子数目为5的是 ( )
| A.Fe3+ | B.P | C.Cr | D.Cu |