(12分) 碳及其化合物与人类关系密切
(1)碳原子的价层电子排布图为 ,C、N、O三元素的第一电离能由大到小的顺序为 ,在丙烯分子中碳原子的杂化方式为 。
(2)固体CO2俗称干冰,干冰可用于人工降雨的原因是 ,干冰晶体内存在的粒子间作用力有 ,其中一个分子周围紧邻的分子有 个。干冰为面心立方晶体,若其晶胞边长为apm, 列式表示该晶体的密度 g·cm-3 (只列出表达式,不必化简)。
(3)金刚石的晶胞如下图(均为同种原子),碳原子的配位数是 ,碳原子与碳碳键个数比为 ,碳原子空间利用率为 (计算结果保留两位有效数字。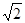 =1.41
=1.41  =1.73)。
=1.73)。
(1)随着生活水平的提高,人们越来越关注营养平衡和自身的健康。
①有些学生从小偏食,不爱吃水果、蔬菜,结果营养缺乏、发育不良,
这主要是由于摄取(填“脂肪”、“维生素”或“蛋白质”)不足引起的。
②青霉素是医学上最早使用的天然素,在体内经酸性水解后得到青霉氨基酸其结构简式为: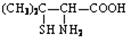 ,请写出青霉氨基酸可能具有的一种化学性质。
,请写出青霉氨基酸可能具有的一种化学性质。
③下列可作为食品着色剂的是A.食盐B.柠檬黄 C.青霉素
(2)①糖类、油脂、蛋白质都是人体必需的营养物质。油脂被摄入人体后,在酶的作用下水解为高级脂肪酸和(写名称)。
②氨基酸是组成蛋白质的基本结构单元,其分子中一定含有的官能团是氨基(—NH2)和(写名称)。人体中共有二十多种氨基酸,其中人体自身(填“能”或“不能”)合成的氨基酸称为人体必需氨基酸。
③淀粉在淀粉酶的作用下最终水解为(写化学式),部分该产物在体内被氧化放出能量,供人体活动需要。
(3)材料通常可分为金属材料、无机非金属材料、高分子合成材料等。
①三大合成材料是指:塑料、合成纤维和;塑料制品造成的环境问题通常称为。
②橡胶是制造轮胎的重要原料,天然橡胶通过措施可增大强度和弹性。
③钢铁在潮湿的空气中更容易被腐蚀,主要原因是其中的铁和碳构成许多微小的,发生电化学腐蚀。发生电化学腐蚀。钢铁发生电化学腐蚀时,负极的电极反应是。
(4)①居室装修所使的人造板材会释放出一种挥发性物质,长期接触会引起过敏性皮炎,免疫功能异常,该挥发性物质是。
②常用的污水处理方法有三种,分别是、中和法和沉淀法。
CO2作为未来碳源,既可弥补因石油、天然气等大量消耗引起的“碳源危机”,又可有效地解决温室效应。请回答下列问题:
(1)将所得CH4与H2O(g)通入聚焦太阳能反应器,发生反应CH4(g)+H2O(g)  CO(g)+3H2(g) △H =" +206" kJ·mol-1。将等物质的量的CH4和H2O(g)充入2 L恒容密闭容器,某温度下反应5 min后达到平衡,此时测得CO的物质的量为0.10 mol,则5 min内H2的平均反应速率为。
CO(g)+3H2(g) △H =" +206" kJ·mol-1。将等物质的量的CH4和H2O(g)充入2 L恒容密闭容器,某温度下反应5 min后达到平衡,此时测得CO的物质的量为0.10 mol,则5 min内H2的平均反应速率为。
平衡后可以采取下列的措施能使n(CO):n(CH4)增大。
A.加热升高温度
B.恒温恒容下充入氦气
C.恒温下增大容器体积
D.恒温恒容下再充入等物质的量的CH4和H2O
(2)工业上可以利用CO为原料制取CH3OH。
已知:CO2(g) +3H2(g)  CH3OH(g) +H2O(g) △H="-49.5" kJ·mol-1
CH3OH(g) +H2O(g) △H="-49.5" kJ·mol-1
CO2(g)+H2(g) CO(g)+H2O(g) △H=" +" 41.3 kJ·mol-1
CO(g)+H2O(g) △H=" +" 41.3 kJ·mol-1
①试写出由CO和H2制取甲醇的热化学方程式。
②该反应的△S0(填“>”或“<”或“=”),在 情况下有利于该反应自发进行。
(3)某科研人员为研究H2和CO合成CH3OH的最佳起始组成比n(H2) : n(CO),在l L恒容密闭容器中通入H2与CO的混合气(CO的投入量均为1 mol),分别在230°C、250°C和270°C进行实验,测得结果如下图,则230℃时的实验结果所对应的曲线是(填字母);理由是。列式计算270℃时该反应的平衡常数K:。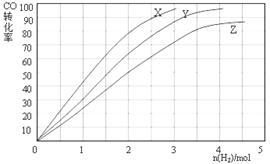
某无机化合物A由X、Y两种元素组成。在空气中充分灼烧得到含X元素的8g红棕色固体B,并产生能使品红褪色的气体C,将该气体全部通入足量的双氧水中得D溶液,再向D溶液中加入足量的BaCl2溶液,过滤、洗涤、干燥得46.6g固体。
(1)写出X在元素周期表中的位置,写出Y2-的结构示意图
写出B的化学式
(2)写出气体C通入H2O2中反应的离子方程式
(3)将A溶于D的稀溶液中得到E,并产生一种单质固体和一种气体,写出该反应的化学方程式
(4)将化合物E固体隔绝空气充分灼烧,使其分解,生成等物质的量的B、C和另一种化合物,则另一种化合物的分子式是;有同学认为该分解反应得到的固体产物中除B外,还可能会有含X元素的低价态物质,请判断该同学的观点是否合理理由是
(5)请设计实验证明E完全分解后的固体产物中是否含有X元素的低价态化合物
)有机玻璃(PMMA)成分为聚甲基丙烯酸甲酯,因其透光性好、性能优良、价格低廉,广泛应用于商业,轻工、建筑、化工等方面,甚至人工角膜也是有机玻璃。其单体的结构和工业合成路线如图所示。
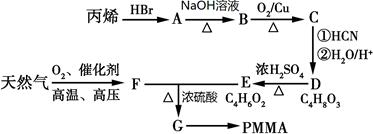
已知:(1)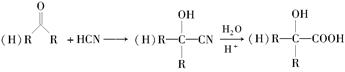
(2)R-Br R-OH
R-OH
请回答下列问题:
(1)写出B中官能团名称,PMMA的结构简式。
(2)判断D→E的反应类型。
(3)写出E+F→G的化学反应方程式。
(4)写出C的一种能与新制氢氧化铜反应的同分异构体。
(选做题二)邻羟基桂皮酸(IV)是合成香精的重要原料,下列为合成邻羟基桂皮酸(IV)的路线之一。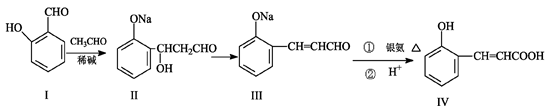
试回答:
(1)I中含氧官能团的名称。
(2)II→III的反应类型。
(3)① IV与乙醇和浓硫酸混合加热的化学方程式:。
② IV与过量NaOH溶液反应的化学方程式:。
(4)下列说法正确的是()
| A.I的化学式为C7H8O2 |
| B.I遇氯化铁溶液呈紫色 |
| C.II能与NaHCO3溶液反应 |
| D.1mol有机物IV最多能与4mol H2加成 |
(5)有机物X与IV互为同分异构体,且X有如下特点:
①是苯的对位取代物,②能与NaHCO3反应放出气体,③能发生银镜反应。
请写出符合上述条件的X的所有结构简式。