如图所示是Zn和Cu形成的原电池,其实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是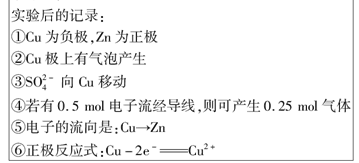
| A.①②③ | B.②④ | C.④⑤⑥ | D.③④⑤ |
2006年9月28日,中国科学家研制的“人造太阳”成功地进行了一次放电。所谓“人造太阳”是指受控核聚变。从1L海水中提取出来的氘(21H)受控核聚变成氦(42He)时产生的能量相当于300L汽油燃烧放出的能量。因此这种技术对解决能源问题有着十分广阔的发展前景。下列有关说法正确的是
| A.氘(2 1H)受控核聚变成氦(4 2He)是一种化学变化 |
| B.21H和42He互为同位素 |
| C.符号21H中的“2”符号42He中“2”意义不同 |
| D.11H2和21H2的互为同素异形体 |
在200 mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入5mol•L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)关系如下图所示。下列叙述正确的是…………………………………………………………………()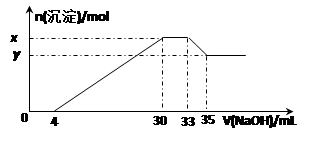
| A.x与y的差值为0.01 mol |
| B.原溶液中c(Cl-)="0.75" mol·L-1 |
| C.原溶液的c(H+)=1mol/L |
| D.原溶液中n(Mg2+)∶n(Al3+)=5∶2 |
下列各组反应(表内物质均为反应物)刚开始时,放出H2的速率最大的是………()
| 编号 |
金属(粉末状) |
物质的量 |
酸的浓度 |
酸的体积 |
反应温度 |
| A |
Mg |
0.1mol |
6mol/L硝酸 |
10mL |
60℃ |
| B |
Mg |
0.1mol |
3mol/L盐酸 |
10mL |
30℃ |
| C |
Fe |
0.1mol |
3mol/L盐酸 |
10mL |
60℃ |
| D |
Mg |
0.1mol |
3mol/L盐酸 |
10mL |
60℃ |
短周期元素X、Y、Z、W、Q在元素周期表中相对位置如图所示。下列说法正确的是………()
| X |
Y |
||||
| Z |
W |
Q |
A.原子半径的大小顺序为:rX>rY>rZ>rW>rQ
B.元素X与元素Z的最高正化合价之和的数值等于8
C.离子Y2—和Z3+的核外电子数和电子层数都不相同
D.元素W的最高价氧化物对应的水化物的酸性比Q的强
在100 mL的溶液中溶有9.5 g MgCl2,此溶液中Cl-的物质的量浓度为…………()
| A.3 mol/L | B.2 mol/L | C.0.3 mol/L | D.0.2 mol/L |