高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示。下列推断合理的是
| A.镍是阳极,电极反应为4OH--4e一= O2↑+ 2 H2O |
| B.电解时电流的方向为:负极→Ni电极→溶液→Fe电极→正极 |
| C.若隔膜为阴离子交换膜,则OH-自右向左移动 |
| D.电解时阳极区pH降低、阴极区pH升高,撤去隔膜混合后,与原溶液比较pH降低(假设电解前后体积变化忽略不计) |
下列化学用语正确的是
A.次氯酸的电子式: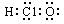 |
B.CH4Si的结构式: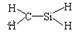 |
| C.HCN分子的结构式:H-C≡N | D.丙烷分子的比例模型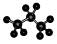 |
下列物质中按照纯净物,混合物,电解质和非电解质的顺序排列的是
| A.盐酸,水煤气,醋酸,干冰 | B.冰醋酸,盐酸,硫酸钠,乙醇 |
| C.苛性钠,石灰石,铁,硫酸钡 | D.胆矾,漂白粉,氯化钾,氯气 |
对于苯乙烯(结构如下图)的下列叙述中:①能使酸性KMnO4溶液退色;②可发生加聚反应;③可溶于水;④可溶于苯中;⑤能与浓硝酸发生取代反应;⑥所有的原子
可能共平面,其中正确的是
| A.仅①②④⑤ | B.仅①②⑤⑥ |
| C.仅①②④⑤⑥ | D.全部正确 |
可逆反应2NO2 (g) 2NO (g) +O2 (g)在体积固定的密闭容器中,达到平衡状态的标志是
2NO (g) +O2 (g)在体积固定的密闭容器中,达到平衡状态的标志是
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2,NO,O2表示的反应速率的比为2:2:1的状态
④混合气体的颜色不再改变的状态⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态
| A.①④⑥⑦ | B.②③⑤⑦ | C.①③④⑤ | D.全部 |
已知短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是
| A.原子半径:A>B>D>C | B.原子序数:d>c>b>a |
| C.离子半径:C3->D->B+>A2+ | D.原子的最外层电子数目:A>B>D>C |