(18分)Ⅰ.实验室常见的几种气体发生装置如图A、B、C所示:
(1)实验室可以用B或C装置制取氨气,如果用B装置制取氨气其化学反应方程式为 。
(2)气体的性质是选择气体收集方法的主要依据。下列性质与收集方法无关的是______(填序号,下同)。
①密度 ②颜色 ③溶解性 ④热稳定性 ⑤与氧气反应
(3)若用A装置与D装置相连制取并收集X气体,则X可以是下列气体中的________。
①CO2 ②NO ③Cl2 ④H2 ⑤HCl
其中在D装置中连接小烧杯的目的是 。
Ⅱ.某小组以CoCl2·6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X。为确定其组成,进行如下实验 。
(4)经测定,样品X中钴、氨和氯的物质的量之比为1∶6∶3 ,钴的化合价为________,制备X的化学方程式为 。
已知:X的化学式类似下列化学式
氢氧化二氨合银:Ag(NH3)2OH 、硫酸四氨合铜:Cu(NH3)4SO4
(5)氨的测定:精确称取w g X,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10% NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用V1 mL cl mol·L-1 的盐酸标准溶液吸收。蒸氨结束后取下接收瓶,用c2 mol·L-1 NaOH标准溶液滴定过剩的HCl,到终点时消耗V2 mL NaOH溶液。
①盛放5(盐酸标准溶液)的仪器名称 。
②装置中安全管的作用原理是 。
③样品中氨的质量分数表达式为 。
已知硫化氢气体可与溴水反应生成硫,下图是用来制取硫化氢并比较硫元素、溴元素非金属性强弱的实验装置。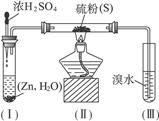
(1)将下列操作步骤补充完整:
①______________________________________________;
②用大火加热使硫沸腾与H2化合;
③______________________________________________;
④停止加热并做善后处理。
(2)装置(Ⅰ)中制氢气不直接用稀硫酸与锌反应,而将浓H2SO4滴入水中,其优点是__________________________________。
(3)装置(Ⅲ)中发生的现象是_______________________________,由此得出的结论是_____________________,反应的离子方程式为____________________________________。
某校开展“研究性学习”中,组织自然科学兴趣小组针对某市热电厂下游境内几十千米内长江中鱼类大量减少的现象,进行了一次调查,并取得了一些资料:
①测定热电厂使用的燃料煤含硫量。测得燃料煤中含硫的质量分数为0.006 4%。
②了解煤燃烧后的气体排放情况。发现:燃烧后的气体未经处理即排放到空气中,该热电厂地处多雨地区。
③了解热电厂发电用水的排放情况。发现:电厂发电用水未经冷却直接排入河中。
根据上述调查资料,完成下列问题:
(1)分析鱼类几近绝迹的原因主要有:
原因一:____________________________________(写化学方程式);
原因二:____________________________________。
(2)项目①中,兴趣小组采用的是_______________分析法。
(3)试计算该热电厂每燃烧1 000 g煤理论上有多少克二氧化硫排放到空气中?
酸雨主要是大量燃烧含硫燃料放出的SO2所造成的。
(1)现有雨水样品1份,每隔一段时间测定该雨水样品的pH,所得数据如下:
| 测定时间/h |
0 |
1 |
2 |
3 |
4 |
| 雨水的pH |
4.73 |
4.62 |
4.56 |
4.55 |
4.55 |
分析数据,完成下列问题:
①雨水样品的pH变化的原因是(用化学方程式表示)________________________________。
②如果将刚取样的上述雨水和自来水混合,pH将变,原因是(用化学方程式表示)_______________________________________________________。
(2)英国的一项研究结果表明:高烟囱可以有效地降低地表面SO2的浓度。在20世纪60—70年代间,由发电厂排出的SO2增加了35%,但由于建筑高烟囱的结果,地面浓度降低了30%之多。请你从全球环境保护的角度,分析这种方法是否可取?简述其理由。
某化学兴趣小组对过量炭粉与氧化铁反应产物中气体的成分进行研究。
(1)假设该反应的气体产物全部是二氧化碳。
(2)设计方案:将一定量氧化铁在隔绝氧气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比。
(3)查阅资料:氮气不与炭、氧化铁发生反应,可用来隔绝氧气。
(4)实验:
| 操作步骤和实验现象 |
简答 |
| ①称取3.2 g氧化铁与2 g炭粉均匀混合,放入48.48 g的玻璃管中,按上图装置连接 |
①写出装置中编号仪器的名称: A__________,B__________ |
| ②加热前,先通入一定量纯净、干燥的氮气 |
②其目的是_______________ |
| ③夹紧T处弹簧夹,加热一段时间,澄清石灰水变浑浊 |
③该现象说明__________ |
| ④完全反应后,冷却至室温,称得玻璃管和固体的总质量为52.24 g |
— |
(5)数据处理:经计算,参加反应的碳元素质量为_________g,氧元素质量为____________g。
(6)结论:根据数据处理结果,得出原假设不成立,理由是_____________________________。
课题式课堂教学是研究性学习的一种重要方式,其基本教学模式为:提出课题→确定研究方案→解决问题→总结和评价。
下面是关于“CO的化学性质”的课题式课堂教学中解决问题阶段:甲同学设计的证明CO具有还原性的实验装置,如图所示。完成下列有关问题:
(1)点燃酒精灯A、B的顺序是_______。
(2)硬质管中发生反应的化学方程式为_____________________。
(3)洗气瓶中的实验现象为_______________________________。
(4)酒精灯B的作用_____________________________________。
(5)乙同学提出甲同学装置太复杂,可将酒精灯合二为一,去掉B,而将尾气导气管出口旋转到A的火焰上即可,乙同学的设计是否合理?简述理由。