常温下,H3PO4与NaOH溶液反应的体系中,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如图所示[已知Ca3(PO4)2难溶于水]。下列有关说法不正确的是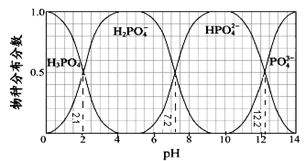
| A.H3PO4的Ka3=10-12.2,HPO42-的水解平衡常数为10-6.8 |
| B.Na2HPO4溶液显碱性,若向溶液中加入足量的CaCl2溶液,溶液则显酸性 |
| C.为获得尽可能纯的NaH2PO4,pH应控制在4~5.5左右 |
| D.pH=13时,溶液中各微粒浓度大小关系为:c(Na+)>c(HPO42-)>c(PO43-)>c(OH-)>c(H+) |
氢氧燃料电池的基本构造如图。A、B是多孔石墨制成,通入的气体由孔隙中逸出,在电极表面得失电子。电解质溶液是KOH溶液 。下列关于该电池的说法中错误的是
。下列关于该电池的说法中错误的是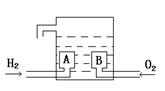
A.H2发生氧化反应 B.e-由B电极流向A电极
C.A电极为负极 D.每摩O2得到4mole-
化学反应A(g)+3B(g)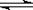 2C(g)+2D(g),在下列四个选项中是不同的情况下测得的不同物质的反应速率,其中表示该化学反应的反应速率最快的是
2C(g)+2D(g),在下列四个选项中是不同的情况下测得的不同物质的反应速率,其中表示该化学反应的反应速率最快的是
A.υ(D)=0.6 mol/(L·min) B.υ(B)=0.45 mol/ (L·s)
C.υ(C)=0.40 mol/ (L·min) D.υ(A)=0.2mol/ (L·s)
已知S2O32-+2H+==S↓+SO2+H2O,某同学进行了硫代硫酸钠(Na2S2O3)与硫酸反应的有关实验,其中反应最快的是
| 实验 序号 |
反应温度:(℃) |
参加反应的物质 |
||||
| Na2S2O3 |
H2SO4 |
H2O |
||||
| V/mL |
c/mol·L-1 |
V/mL |
c/mol·L-1 |
V/mL |
||
| A |
40 |
5 |
0.1 |
10 |
0.1 |
0 |
| B |
20 |
5 |
0.1 |
10 |
0.1 |
0 |
| C |
20 |
10 |
0.1 |
5 |
0.1 |
5 |
| D |
40 |
5 |
0.1 |
10 |
0.1 |
5 |
下列热化学方程式中△H的绝对值表示可燃物燃烧热的是
A.CO(g)+ 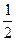 O2(g) ===CO2(g O2(g) ===CO2(g )△H=-283.0 kJ·mol-1 )△H=-283.0 kJ·mol-1 |
| B.CH4(g)+ 2O2(g) ===CO2(g)+2H2O(g)△H=-802.3 kJ·mol-1 |
| C.2H2(g)+ O2(g) ===2H2O(l)△H=-571.6kJ·mol-1 |
D.C(s)+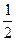 O2(g) ===CO(g)△H=-110.5kJ·mol-1 O2(g) ===CO(g)△H=-110.5kJ·mol-1 |
下列说法中错误的是
| A.许多化学反应中的能量变化表现为热量的放出和吸收 |
| B.化学键的断裂和形成是化学反应中能量变化的主要原因 |
| C.选择燃料只需要考虑燃料热值的大小 |
| D.若反应物总能量大于生成物总能量则反应为放热反应 |