某离子化合物的晶胞如图所示立体结构,阳离子位于此晶胞的中心,阴离子位于8个顶点,
该离子化合物中,阴、阳离子个数比是
| A.1∶8 | B.1∶4 | C.1∶1 | D.1∶2 |
下列叙述正确的是
①标准状况下,1molSO2和1molSO3的体积相同;②SO2通入BaCl2溶液中不会有沉淀生成;③SO2有漂白性,而湿润的氯气也有漂白性,因此将SO2和Cl2以等物质的量混合后漂白作用更强;④SO2既有氧化性又有还原性;⑤SO2通入Ba(OH)2溶液中有白色沉淀生成,若加入足量的稀硝酸,沉淀将全部溶解
| A.①② | B.②④⑤ | C.②④ | D.③⑤ |
下列离子方程式正确的是


| A.醋酸溶液中滴入少量氢氧化钠溶液:H++OH-= H2O |
| B.在小苏打溶液中滴入少量的氢氧化钡溶液:2HCO3-+Ba2++2OH-=2BaCO3↓+2H2O |
C.硫酸铵溶液与氢氧化钡溶液混合加热:NH4++OH-  NH3↑+ H2O NH3↑+ H2O |
| D.锌与稀硝酸反应:Zn+2H+=Zn2++H2↑ |
实验室里可按图所示的装置来干燥、收集气体R,多余的气体R可用水吸收,则R是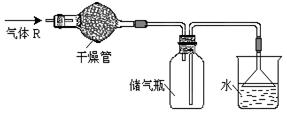
| A.HCl | B.Cl2 | C.CO | D.NH3 |
氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成: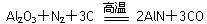
下列叙述正确的是


| A.在氮化铝的合成反应中,N2是还原剂,Al2O3是氧化剂 |
| B.上述反应中每生成2 mol AlN,N2得到3 mol电子 |
| C.氮化铝中氮元素的化合价为-3 |
| D.氮化铝晶体属于分子晶体 |
下列试剂的贮存方法中正确的是


①浓硝酸存放在棕色试剂瓶中②少量白磷存放在水中
③液溴保存在水中④少量金属钠贮存在煤油中
⑤氢氟酸保存在玻璃瓶中⑥烧碱溶液盛放在带玻璃塞的玻璃瓶中
| A.全对 | B.只有①②③ | C.只有①②③④ | D.只有⑤⑥ |