在容积一定的密闭容器中,反应2A 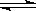 B(g)+C(g)达到平衡后,升高温度容器内气体的密度增大,则下列叙述正确的是
B(g)+C(g)达到平衡后,升高温度容器内气体的密度增大,则下列叙述正确的是
| A.正反应是吸热反应,且A是气态 |
| B.正反应是放热反应,且A不是气态 |
| C.其他条件不变,加入少量A,该平衡不移动 |
| D.改变压强对该平衡的移动无影响 |
以下表示氦原子结构的化学用语中,对电子运动状态描述最详尽的是
| A.∶He | B.1s2 |
C. |
D. |
下列说法中正确的是
| A.处于最低能量的原子叫做基态原子 |
| B.3p2表示3p能级有两个轨道 |
| C.同一原子中,1s、2s、3s电子的能量逐渐减小 |
| D.同一原子中,2p、3p、4p能级的轨道数依次增多 |
氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为
a HClO3 = bO2↑+ c Cl2↑+ d HClO4 + e H2O。下列有关说法不正确的是
| A.由反应可确定:氧化性HClO3>O2 |
| B.若氯酸分解所得混合气体,lmol混合气体质量为45g,则反应方程式可表示为:3HClO3 = 2O2↑+ C12↑+ HClO4 + H2O |
| C.由非金属性Cl>S,可推知酸性HClO3>H2SO4 |
| D.若化学计量数a=8,b=3,则该反应转移电子数为20e- |
下列现象或事实不能用同一原理解释的是
| A.浓硝酸和氯水用棕色试剂瓶保存 |
| B.硫化钠和亚硫酸钠固体长期暴露在空气中变质 |
| C.常温下铁和铂都不溶于浓硝酸 |
| D.SO2和Na2SO3溶液都能使氯水褪色 |
下列各种溶液中通入足量的SO2后,既无沉淀又无气体产生的是
①NaClO ②C6H5ONa ③Na2S④BaCl2⑤Ba(OH)2⑥H2O2
| A.①④⑥ | B.①②③ | C.④⑤⑥ | D.①④⑤⑥ |