三氟化氮(NF3)是一种无色、无味、无毒且不可燃的气体, 它可在铜的催化作用下由F2和过量的NH3反应得到,该反应另一种产物为盐。
(1)生成物NF3中氮原子的轨道杂化方式为 ,NF3分子空间构型为 ;键角 109°28′(填“大于” “小于” “等于”) 。
(2)N3-被称为类卤离子,写出1种与N3-互为等电子体的分子的化学式 。
(3)某元素X跟氟可形成离子晶体,其晶胞结构如图,该离子化合物的化学式为(用X、F表示) ;X阳离子的配位数为 。
(4)若晶胞边长为a cm,该离子化合物的摩尔质量为M g/mol,则该晶体的密度为 g· cm-3(用a、M、NA表达)。
某有机物的结构简式为HOOC—CH=CHCH2OH。
(1)请你写出该有机物所含官能团的名称:________、________、________。
(2)验证该有机物中含有—COOH官能团常采用的方法是__________________,
产生的现象为____________________。
如图是A分子的球棍模型和B分子的比例模型,回答下列问题:
(1)A和B的关系是_____。
(2)写出A分子在催化剂存在条件下加热和氧气反应的化学方程式___________。
(3)写出B分子和金属钠反应的化学方程式_____________________。
(4)B在加热条件下能够和HBr发生反应生成溴乙烷,该反应类型是____________。
某烃A不能使溴水褪色,0.5 mol A完全燃烧时,得到1.5 mol H2O和67.2 L CO2(标准状况)。
(1)A的结构简式为___________________。
(2)根据下列条件写出有关反应的化学方程式。
①在催化剂FeCl3的作用下,A与Cl2反应生成B:________________。
②在催化剂作用下,A与H2反应生成C:__________。
甲烷、乙烯、苯、甲苯四种有机物中具有下列性质的是:
(1)不能与溴水反应,能使酸性高锰酸钾溶液褪色的是________________。
(2)在催化剂作用下能与纯溴反应,不能使酸性高锰酸钾溶液褪色的是________。
(3)见光能跟氯气反应,不能使酸性高锰酸钾溶液褪色的是________。
(4)在催化剂作用下加氢生成乙烷,加水生成酒精的是________。
某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应。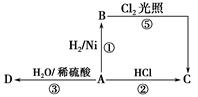
据图回答下列问题:
(1)写出A、C、D的结构简式:
A________,C________,D________。
(2)写出①②两步反应的化学方程式,并注明反应类型:
①________________________________(反应类型____________)。
②________________________________(反应类型____________)。