元素R、T、X、Y、Z在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸,生成HR。则下列判断正确的是
| A.非金属性:Z<Y<X |
| B.R与Y的电子数相差8 |
| C.气态氢化物稳定性:HR<HY<HT |
| D.最高价氧化物的水化物的酸性:HTO4>HYO4 |
在25 ml 0.1 mol · L-1NaOH溶液中逐滴加入0.2mol · L-1CH3COOH溶液,溶液pH变化曲线如图所示,下列有关离子浓度的比较正确的是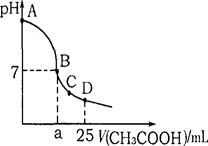
A.在A、B间任一点(不含A、B点),溶液中可能有c (Na+) > c (CH3COO-) >c (OH-) > c (H+)
B.在B点,a>12.5,且有c (Na+) ="c" (CH3COO-) =" c" (OH-)=" c" (H+)
C.在C点,c (CH3COO-) > c (Na+) > c (OH-) > c (H+)
D.在D点,c (CH3COO-) +c (CH3COOH) =" c" (Na+)
用石墨电极电解100 mL H2SO4与CuSO4的混合溶液,通电一段时间后,两极均收集
到2.24 L气体(标准状况),则原混合溶液中Cu2+的物质的量浓度为
| A.1mol·L-1 | B.2 mol·L-1 | C.3 mol·L-1 | D.4 mol·L-1 |
某二元弱酸H2A,在溶液中可以发生一级和二级电离:H2A H++HA-,HA-
H++HA-,HA- H++A2-,已知相同浓度时H2A比HA-容易电离,在相同温度时下列溶液中H2A浓度最大的是
H++A2-,已知相同浓度时H2A比HA-容易电离,在相同温度时下列溶液中H2A浓度最大的是
| A.0.01 mol/L的H2A溶液 |
| B.0.01 mol/L的NaHA溶液 |
| C.0.02 mo|/L的NaOH溶液与0.02 mol/L的NaHA溶液等体积混合 |
| D.0.02 mol/L的HCl溶液与0.04 mol/L的NaHA溶液等体积混合 |
下列方程式的书写或描述正确的是
| A.用碳酸钠溶液浸泡锅炉水垢:CaSO4+CO32- |
B.热化学方程式C2H2(g)+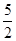 O2(g) O2(g) |
C.铂电极电解MgCl2饱和溶液: |
| D.H+(aq)+OH(aq) |
下列叙述正确的是
| A.将稀氨水逐滴加入稀硫酸中,当溶液的pH=7时,c(SO42-)>c(NH4+) |
| B.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2 |
| C.pH=13的NaOH溶液与pH=1的醋酸溶液等体积混合,滴入石蕊溶液呈红色 |
D.向0.1mol·L-1的氨水中加入少量硫酸铵固体,则溶液中 增大 增大 |