甲同学设计并进行了如下实验,以探究乙炔与溴的加成反应:先取一定量工业用电石与水反应,将生成的气体通入足量的溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应。乙同学发现在甲同学的实验中,褪色的溶液里有少许黄色浑浊,推测在制得乙炔中还可能含有少量还原性的杂质气体,由此他提出必须先除去之,再与溴水反应。请你回答下列问题:
(1)写出甲同学实验中的两个化学方程式: 、 。
(2)乙认为甲设计的实验不能验证此反应为加成反应,其理由是 。
| A.使溴水褪色的物质,就是乙炔 |
| B.使溴水褪色的反应就是加成反应 |
| C.使溴水褪色的物质,未必是乙炔 |
| D.使溴水褪色的反应未必是加成反应 |
(3)乙同学推测此乙炔中必定含有的一种杂质气体是 ,在验证过程中必须全部除去,它与溴水反应的化学方程式是 。
(4)请你选用下列三个装置(见下图)(可重复使用)来实现乙同学的实验方案,将它们的编号填入方框,并写出装置内所放的化学药品。
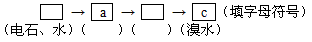
(5)为验证这一反应是加成而不是取代,丙同学提出可用pH试纸来测试反应后溶液的酸性,理由是 。
某研究小组欲探究SO2的化学性质,设计了如下实验方案。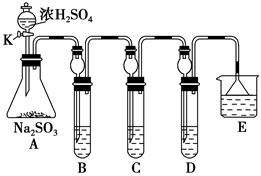
(1)在B中检验SO2的氧化性,则B中所盛试剂可为________。
(2)在C中装FeCl3溶液,检验SO2的还原性,则C中反应的离子方程式为_____________________________________________________。
(3)在D中装新制漂白粉浓溶液。通入SO2一段时间后,D中出现了大量白色沉淀。同学们对白色沉淀成分进行了探究。请回答下列问题:
限选的仪器和试剂:过滤装置、试管、滴管、带导管的单孔塞、蒸馏水、0.5 mol·L-1盐酸、0.5 mol·L-1H2SO4溶液、0.5 mol·L-1BaCl2溶液、品红溶液、新制澄清石灰水。
(ⅰ)假设一:该白色沉淀为CaSO3;
假设二:该白色沉淀为________;
假设三:该白色沉淀为上述两种物质的混合物。
(ⅱ)基于假设一,填写下表:
| 实验操作 |
预期现象和结论 |
| 将D中沉淀过滤,洗涤干净备用 |
|
| 用另一干净试管取少量沉淀样品,加入______________ |
_________________________ |
(ⅲ)若假设二成立,试写出生成该白色沉淀的化学方程式:
__________________________________________________。
某研究小组在实验室中用铜粉(含铁粉5%以上)制取胆矾(CuSO4·5H2O)并检验其纯度,限选试剂:3 mol·L-1H2SO4溶液、浓硝酸、3%H2O2溶液、0.2 mol·L-1NaOH溶液、20% KSCN溶液、BaCl2溶液。有关物质溶解度如下表(单位g/100 g H2O):
| 温度/℃ |
0 |
20 |
40 |
60 |
80 |
100 |
| CuSO4 |
14.3 |
20.7 |
28.5 |
40.0 |
55.0 |
75.4 |
| Cu(NO3)2 |
81.8 |
124.8 |
163.1 |
181.8 |
207.8 |
247.3 |
(1)完成制取胆矾的实验方案。
| 实验步骤 |
预期现象 |
| 步骤1:除铁。将铜粉置于烧杯中,__________________ |
_______________________ |
| 步骤2:溶解。将步骤1得到的铜粉置于烧杯中, __________________________ |
_______________________ |
| 步骤3:结晶。将步骤2所得溶液蒸发浓缩至液面有晶膜出现,冷却至室温,过滤得粗产品 |
(2)完成步骤1后,检验铜粉中的铁是否除尽的实验操作是___________。
(3)若胆矾中含有少量Cu(NO3)2·3H2O,测定其中CuSO4·5H2O的含量,实验步骤如下:称量胆矾样品的质量为m1,加水溶解,滴加足量BaCl2溶液,充分反应后过滤,将滤渣烘干、冷却,称得其质量为m2。样品中CuSO4·5H2O的质量分数为________(列出算式)。
某课外活动兴趣小组欲用下列化学试剂在实验室里制取Cl2并验证Cl2的某些化学性质。实验试剂:3 mol·L-1 H2SO4、1 mol·L-1 NaOH溶液、MnO2、KMnO4、吸收少量SO2的NaOH溶液、浓盐酸、紫色石蕊试液、饱和NaCl溶液、BaCl2溶液、品红溶液。甲小组设计的实验装置图如下,在B中加入吸收少量SO2的NaOH溶液,D中加入1 mol·L-1 NaOH溶液。请回答下列问题:
Ⅰ. (1)写出仪器X的名称:________。
(2)写出A中发生反应的化学方程式:__________________________,不能用E装置代替
A装置的原因是__________________________________________。
(3)C装置的作用是_______________________________________。
(4)甲小组通过该实验要验证Cl2的________(填“漂白性”、“还原性”或“氧化性”)。
(5)乙小组认为甲小组设计的实验装置有缺陷,请你帮助甲小组完善该装置。即还要在________和________(填“A”、“B”、“C”或“D”)装置间连接一个装有________的洗气装置。
Ⅱ.丙小组认为反应一段时间后,B装置溶液(强碱性)中肯定存在Cl-、OH-和SO42—,可能还含有其他的阴离子。
请你设计实验帮助丙小组探究该吸收液中可能存在的其他阴离子。
(1)提出合理假设
假设1:只存在________,或只存在________。
假设2:可能两者都________(填“存在”或“不存在”)。
(2)请设计实验验证假设的正确性:_____________________________。
硫酸铜受热分解生成氧化铜和气体,加热温度不同,气体成分也不同。气体成分可能含SO2、SO3和O2中的一种、两种或三种。某化学课外活动小组通过设计探究性实验,测定反应产生的SO2、SO3和O2的物质的量,并计算确定各物质的化学计量数,从而确定CuSO4分解的化学方程式。实验用到的仪器如下图所示:
[提出猜想]
Ⅰ.所得气体的成分可能只含SO3一种;
Ⅱ.所得气体的成分可能含有________两种;
Ⅲ.所得气体的成分可能含有________三种。
[实验探究]
实验操作过程略。已知实验结束时,硫酸铜完全分解。
(1)请你组装探究实验的装置,按从左至右的方向,各仪器接口的连接顺序为①→⑨→⑩→⑥→⑤→________→________→________→________→②(填接口序号)。
(2)若实验结束时B中量筒没有收集到水,则证明猜想________正确。
(3)有两个实验小组进行该实验,由于加热时的温度不同,实验结束后测得相关数据也不同,数据如下:
| 实验小组 |
称取CuSO4的质量/g |
装置C增加的质量/g |
量筒中水的体积折算成标准状况下气体的体积/mL |
| 一 |
6.4 |
2.56 |
448 |
| 二 |
6.4 |
2.56 |
224 |
请通过计算,推断出第一小组和第二小组的实验条件下CuSO4分解的化学方程式。
第一小组:______________________________________________;
第二小组:_______________________________________________。
某小组的同学对放置已久的过氧化钠的成分进行探究,请回答下列问题:
(1)反应2Na2O2+2H2O===4NaOH+O2↑的还原剂是________(写化学式);反应2Na2O2+2CO2===2Na2CO3+O2中,每生成1 mol O2转移________mol电子。
(2)进行探究:
①提出假设。
假设1:全部是Na2O2
假设2:全部是Na2CO3
假设3:________________
②设计方案,进行实验。请写出实验步骤以及预期现象和结论(可不填满)。
限选实验试剂和仪器:蒸馏水、1 mol·L-1 H2SO4溶液、澄清石灰水、淀粉-KI溶液、酚酞溶液、火柴、试管、小烧杯、胶头滴管。
| 实验步骤 |
预期现象和结论 |
| 步骤1:取少量固体样品于试管中,滴加足量1 mol·L-1 H2SO4溶液,然后将内壁附有澄清石灰水的烧杯罩于试管口 |
若澄清石灰水未见浑浊,则假设1成立; 若澄清石灰水变浑浊,则______________________ |
| 步骤2: |
|
| 步骤3: |