下列离子方程式书写正确的是
| A.向FeI2的溶液中,通入足量Cl2:2Fe2++2I-+2Cl2=I2+2Fe3++4Cl- |
| B.Fe(OH)3溶于氢碘酸:Fe(OH)3 + 3H+=Fe3+ + 3H2O |
| C.向水玻璃中通入过量的CO2:SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3- |
| D.酸性条件下KIO3溶液与KI溶液发生反应生成I2:IO3-+5I-+3H2O=3I2+6OH- |
下列关于纯净物、混合物、强电解质、弱电解质和非电解质的正确组合是
| 纯净物 |
混合物 |
强电解质 |
弱电解质 |
非电解质 |
|
| A |
盐酸 |
玻璃 |
硫酸 |
氨水 |
干冰 |
| B |
氢氧化钡 |
植物油 |
硫酸钡 |
醋酸 |
水 |
| C |
胆矾 |
淀粉 |
熟石灰 |
水 |
氨气 |
| D |
硝酸 |
汽油 |
硫酸 |
氢硫酸 |
氢气 |
下列说法正确的是
| A.ΔH>0、ΔS>0的反应一定不能自发进行 |
| B.反应4Al(s)+3O2(g)=2Al2O3 (s)的ΔH<0、ΔS>0 |
| C.反应物分子有效碰撞次数增加则反应物的浓度一定增加 |
| D.压强和浓度对反应速率的影响都是通过改变单位体积活化分子数从而影响有效碰撞次数来实现的 |
低温脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:2NH3(g)+NO(g)+NO2(g) 2N2(g)+3H2O(g)ΔH<0
2N2(g)+3H2O(g)ΔH<0
在恒容的密闭容器中,下列有关说法正确的是
| A.平衡时,其他条件不变,升高温度可使该反应的平衡常数增大 |
| B.平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小 |
| C.单位时间内消耗NO和N2的物质的量比为1∶2时,反应达到平衡 |
| D.其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大 |
在密闭容器中将CO和水蒸气的混合物加热到800℃时,有下列平衡:CO+H2O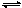 CO2+H2,且K=1。若用2molCO和10mol H2O相互混合并加热到800℃,则CO的转化率为
CO2+H2,且K=1。若用2molCO和10mol H2O相互混合并加热到800℃,则CO的转化率为
| A.16.7% | B.50% |
| C.66.7% | D.83.3% |
一定温度下,有可逆反应:2A(g)+2B(g)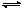 C(g)+3D(g)ΔH<0。现将2molA和2molB充入体积为V的甲容器,将2molC和6molD充入乙容器并使乙容器在反应开始前的体积为2V(如图1)。
C(g)+3D(g)ΔH<0。现将2molA和2molB充入体积为V的甲容器,将2molC和6molD充入乙容器并使乙容器在反应开始前的体积为2V(如图1)。
关于两容器中反应的说法正确的是
| A.甲容器中的反应先达到化学平衡状态 |
| B.两容器达平衡后升高相同的温度,两容器中物质D的体积分数随温度变化如图2所示 |
| C.两容器中的反应均达平衡时,平衡混合物中各组份的体积百分组成相同,混合气体的平均相对分子质量也相同 |
| D.在甲容器中再充入2molA和2molB,平衡后甲中物质C的浓度与乙中物质C的浓度相等 |