某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验。
Ⅰ.(1)将钠、钾、镁、铝各1 mol分别投入到足量的0.1 mol·L-1的盐酸中,试预测实验结果:____与盐酸反应最快,相同条件下所得气体体积比是____________。
(2)将NaOH溶液与NH4Cl溶液混合生成NH3·H2O,从而验证NaOH的碱性大于NH3·H2O,继而可以验证Na的金属性大于N,你认为此设计是否合理?并说明理由 ____。
Ⅱ.利用下图装置可以验证非金属性的变化规律。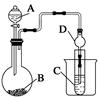
(3)仪器A的名称为 ,干燥管D的作用是_______________。
(4)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性大于硫:
装置B中的化学方程式_______________________ 。
装置C中的实验现象为____________________________。离子方程式为____________。
(5)若要证明非金属性:C>Si,则A中加 、B中加Na2CO3、C中加 ,观察到C中溶液的现象为_______________________________。
(共3分)下列有关实验的叙述,不正确的是(填序号)。
| A.配制500 mL某物质的量浓度的溶液,可用两只250 mL的容量瓶 |
| B.用渗析法分离淀粉中混有的NaCl杂质 |
| C.用酸式滴定管量取20.00mL高锰酸钾溶液 |
| D.在C2H5Cl与NaOH溶液共热的混合物中,加入AgNO3溶液即可检验氯元素 |
E.在中学《硫酸铜晶体里结晶水含量测定》的实验中,称量操作至少需要三次
F.在氢氧化铁胶体中加入少量硫酸会产生沉淀
G.用结晶法可以除去硝酸钾中混有的少量氯化钠
(13分)根据要求完成下列各小题实验目的。(a、b为弹簧夹,加热及固定装置已略去)
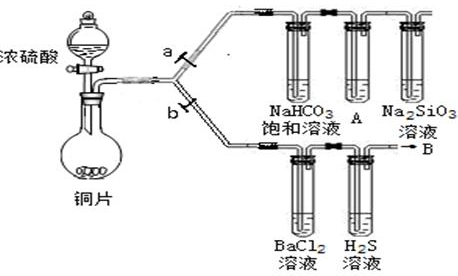
(1)验证碳、硅非金属性的相对强弱。(已知酸性:亚硫酸>碳酸)
①连接仪器、检验装置气密性、加药品后,打开a关闭b,然后滴入浓硫酸,加热。
②铜与浓硫酸反应的化学方程式是___________________________。装置A中试剂是________________。
③能说明碳的非金属性比硅强的实验现象是________________________________________________。
(2)验证SO2的氧化性、还原性和酸性氧化物的通性。
①在(1)①操作后打开b,关闭a。
②H2S溶液中有浅黄色浑浊出现,化学方程式是______________________________________。
③BaCl2溶液中无明显现象,将其分成两份,分别滴加下列溶液,将产生的沉淀的化学式填入下表相应位置。
| 滴加的溶液 |
氯水 |
氨水 |
| 沉淀的化学式 |
|
|
写出其中SO2显示还原性并生成沉淀的离子方程式__________________________________。
④将KOH和Ca(OH)2的混合物1.3g全部溶于一定量水中形成稀溶液,再缓缓通入一定量的B气体,实验过程中可得到沉淀的最大质量为1.2g。
试计算:原混合物中KOH的质量为_____________g。生成沉淀质量为最大时,消耗B气体(标准状况下)的体积(V)范围是:_____________________________________。
研究某一化学反应的实验装置右如下图所示:A~F属于下列物质中的六种物质:浓硫酸、浓盐酸、浓氨水、稀硫酸、稀盐酸、稀氯水、水、锌粒、铜片、食盐、高锰酸钾、氯化钙、氧化钙、四氧化三铁、氧化铁、氧化铜、氢气、二氧化碳、二氧化氮、一氧化碳、氯气、氯化氢、氨气、氮气、氧气。实验现象;①D物质由黑色变为红色②无水硫酸铜粉末放入无色透明的E中得到蓝色溶液③点燃的镁条伸入无色无味的F中镁条表面生成一种固体物质。将该物质放入水中,有气体放出,该气体具有刺激性气味。并能使润湿的红色石蕊试纸变蓝。通过分析回答: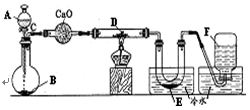
(1)写出A~F的物质名称:A.,B., E.,
(2)写出有关的化学方程式: C与D;
F与Mg的反应产物与水。
氯气是一种重要的工业原料。
(1)实验室可用二氧化锰和浓盐酸反应制取氯气,反应的化学方程式是
。
(2)资料显 示:Ca(ClO)2 +CaCl2+2H2SO4
示:Ca(ClO)2 +CaCl2+2H2SO4 2CaSO4+2Cl2↑+2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
2CaSO4+2Cl2↑+2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。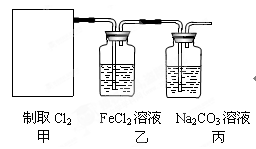
①在该实验中,甲部分的装置是(填字母)。
②乙装置中FeCl2溶液与Cl2反应的离子方程式是 。
。
证明FeCl2与Cl2发生了氧化还原反应的实验方法是。
③丙装置中通入少量Cl2,可制得某种生活中常用的漂白、消毒的物质。已知碳酸的酸性强于次氯酸,则丙中发生反应的化学方程式是。
④该实验存在明显的缺陷,改进的方法是 。
。
(3)为测定漂白粉中Ca(ClO)2的质量分数,该小组将2 g漂白粉配制成250 mL溶液,取出25 mL并向其中依次加入过量稀H2SO4、过量KI溶液,完全反应后,再滴入0.1 mol/L Na2S2O3溶液:2Na2 S2O3+I2 ="==" Na2S4O6+2NaI,共消耗20 mL Na2S2O3,则漂白粉中Ca(ClO)2的质量分数为。
S2O3+I2 ="==" Na2S4O6+2NaI,共消耗20 mL Na2S2O3,则漂白粉中Ca(ClO)2的质量分数为。
某研究性学习小组用如下图装置进行铜与浓硫酸反应的实验研究。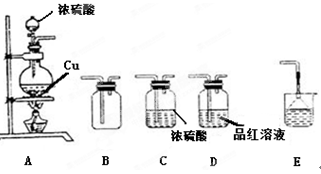
(1)装置A中发生反应的化学方程式;
(2)若要使B 中收集满干燥的SO2气体(并证实B中已收集满),则上述装置的连接顺序为:接接接接(用字母表示)
(3)待烧瓶中充分反应后,同学们发现铜有剩余。经检测发现硫酸也有剩余.其原因是;
检验硫酸有剩余的方法是.
(4)在不补充浓硫酸的前提下.为使铜进一步溶解,可向烧瓶中加入(填序号)
①盐酸② FeSO4③ Fe2O3④KNO3