已知阴离子A2-的原子核内有x个中子,A原子的质量数为m,则Wg A2-含有电子的物质的量为
| A.(m-x-2)/m mol | B.W(m-x)/m mol |
| C.W(m-x-2)/m mol | D.W(m-x+2)/m mol |
氧族元素包括氧、硫、硒、碲、钋等,右图为氧族元素氢化物a、b、c、d的生成热数据示意图,下列关于氧族元素的说明正确的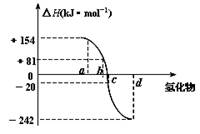
| A.含有18e-的两种氢化物中只存在极性键 |
| B.氢化物的沸点大小是H2O<H2S<H2Se<H2Te |
| C.a所对应的氢化物是H2O |
| D.每1mol H2S分解会吸收20KJ的热量 |
下列各组中的反应,属于同一反应类型的是( )
| A.乙烷和氯气制氯乙烷;乙烯与氯化氢反应制氯乙烷 |
| B.乙醇和氧气制乙醛;葡萄糖与新制的氢氧化铜共热 |
| C.蔗糖与稀硫酸共热;苯和氢气制环己烷 |
| D.乙醇制乙烯;苯的硝化反应 |
下列离子方程式书写不正确的是
| A.NaOH溶液与SO2反应,当n(NaOH)∶n(SO2)=4∶3时:4OH- + 3SO2 = SO32-+ 2HSO3-+ H2O |
| B.酸性条件下KIO3溶液与KI溶液发生反应生成I2:IO3-+5I-+3H2O=3I2+6OH- |
| C.AgNO3溶液中加入过量的氨水:Ag++2NH3·H2O=[Ag(NH3)2]++2H2O |
| D.1 mol·L-1的NaAlO2溶液和2.5 mol·L-1的HCl等体积互相均匀混合:2AlO2-+5H+=Al(OH)3↓+Al3++H2O |
下列叙述中,正确的是
| A.甲烷的标准燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为: CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1 |
B.500 ℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为: ΔH=-38.6 kJ·mol-1 ΔH=-38.6 kJ·mol-1 |
| C.活化能的作用在于使反应物活化,所以化学反应的活化能不可能接近于零或等于零 |
| D.常温下,反应C(s)+CO2(g)===2CO(g)不能自发进行,则该反应的ΔH>0 |
实验室需配制一种仅含五种离子(水电离出的离子可忽略)的混合溶液,且在混合溶液中五种离子的物质的量浓度均为1 mol/L,下面四个选项中能达到此目的的是
| A.Ca2+、K+、OH−、Cl−、NO3− | B.Fe2+、H+、Br−、NO3−、Cl− |
| C.Na+、K+、SO42−、NO3−、Cl− | D.Al3+、Na+、Cl−、SO42−、NO3− |