下列有关化学用语使用正确的是
A.硫原子的原子结构示意图:  |
B.原子核内有10个中子的氧原子:  |
C.NH4Cl的电子式: |
| D.高氯酸(HClO4)中氯元素的化合价为+5 |
有人设想合成具有以下结构的烃分子,下列说法不正确的是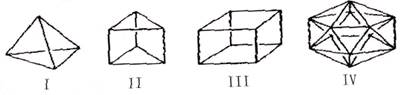
| A.Ⅳ不可能合成得到 |
| B.Ⅱ与苯互为同分异构体 |
| C.Ⅲ(立方烷)的六氯代物共有3种 |
| D.Ⅰ中各键之间夹角为109°28’ |
一定温度时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,发生反应:PCl5(g)⇌Cl2(g)
+PCl3(g)经一段时间后反应达到平衡。反应过程中测得的部分数据见下表:
下列说法正确的是
| A.反应在前50 s内的平均速率为v(PCl3)="0.0032" moI·L-l·s-l |
| B.保持其他条件不变,若升高温度,反应重新达到平衡,平衡时c(PCl3)=0.11moI·L-l, 则正反应的△H<0 |
| C.相同温度下,若起始时向容器中充入1.0 molPCl5、0.20mol PCl3和0.20 mol Cl2,则反应达到平衡前v(正)<v(逆) |
| D.相同温度下,若起始时向容器中充入1.0mol PCl3、1.0 mol Cl2,则反应达到平衡时PCl3的转化率为80% |
相同温度、相同容积的四个密闭容器中进行同样的可逆反应:2X(g)+Y(g) 3W(g)+2Z(g)△H=-Q KJ/mol,起始时充入气体的物质的量及平衡时体系能量变化数据如下表:
3W(g)+2Z(g)△H=-Q KJ/mol,起始时充入气体的物质的量及平衡时体系能量变化数据如下表:
| X |
Y |
W |
Z |
反应体系能量变化 |
|
| 甲 |
2mol |
1mol |
放出a kJ/mol |
||
| 乙 |
1mol |
1mol |
放出b kJ/mol |
||
| 丙 |
2mol |
2mol |
放出c kJ/mol |
||
| 丁 |
3mol |
2mol |
吸收d kJ/mol |
下列说法正确的是
A.c+d<Q
B.平衡时,甲、丁容器中X、W的转化率之和等于1
C.平衡时丙容器中Z的物质的量浓度最大
D.X的转化率为:甲<乙<丙
在一密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:
Ni(s)+4CO(g)  Ni(CO)4(g),
Ni(CO)4(g),
已知该反应在25 ℃和80 ℃时的平衡常数分别为5×104和2。
下列说法正确的是
| A.恒温恒容下,向容器中再充入少量Ni(CO)4(g),达新平衡时,Ni(CO)4百分含量将增大 |
| B.在80 ℃时,测得某时刻Ni(CO)4、CO浓度均为0.5 mol·L-1,则此时v(正)<v(逆) |
| C.恒温恒压下,向容器中再充入少量的Ar,上述平衡将正向移动 |
| D.上述生成Ni(CO)4(g)的反应为吸热反应 |
在密闭容器中,反应2HI H2+I2 △H > 0,当达到平衡时,欲使混合气体颜色加深,可采取的措施有
H2+I2 △H > 0,当达到平衡时,欲使混合气体颜色加深,可采取的措施有
| A.减小容器体积 | B.降低温度 |
| C.加入催化剂 | D.恒容下充入HI气体 |