甲、乙、丙、丁四种物质分别含两种或三种元素,它们的分子中各含l8个电子。甲是气态氢化物,在水中分步电离出两种阴离子。下列推断合理的是
A.某钠盐溶液含甲电离出的阴离子,则该溶液只能与酸反应
B.丁和甲中各元素质量比相同,则丁中一定含有-l价的元素
C.丙中含有第二周期ⅣA族的元素,则丙一定是只含C、H的化合物
D.乙与氧气的摩尔质量相同,则乙一定含有极性键和非极性键
下列事实与氢键无关的是
| A.冰晶体的密度小于液态水 |
| B.实验测得水蒸气的摩尔质量大于18g/mol |
| C.氯化氢极易溶于水,而甲烷难溶于水 |
D.邻羟基苯甲醛(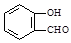 )沸点低于对羟基苯甲醛( )沸点低于对羟基苯甲醛( ) ) |
下表中各粒子、粒子对应的立体结构及解释均正确的是
| 分子 |
立体结构 |
原因 |
|
| A |
甲醛(HCHO) |
平面三角形 |
C原子采用sp2杂化且C原子的价电子均参与成键 |
| B |
三氯甲烷(CH3Cl) |
正四面体 |
C原子采用sp3杂化且C原子的价电子均参与成键 |
| C |
铵根离子(NH4+) |
三角锥型 |
N原子采用sp3杂化且4个N-H完全一样 |
| D |
水分子(H2O) |
直线型 |
O原子采用sp3杂化但O原子有两对价电子未参与成键 |
解释下列物质性质的变化规律时,与共价键的键能无关的是
| A.N2比P4的化学性质稳定 |
| B.F2、C12、Br2、I2的沸点逐渐升高 |
| C.金刚石的熔点比晶体硅高 |
| D.HF、HCl、HBr、HI的热稳定性依次减弱 |
下列有机化合物中含有手性碳原子的是
| A.乙醇(CH3CH2OH) |
B.甘油(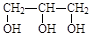 ) ) |
C.乳酸( ) ) |
D.苯乙烯(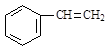 ) ) |
下列各组物质形成的晶体中,晶体类型相同的是
| A.晶体硅和SiC | B.C60和Mg | C.NaCl和HCl | D.SO2和SiO2 |