短周期元素W、X、Y和Z的原子序数依次增大。W原子是半径最小的原子,非金属元素X形成的一种单质能导电,元素Y是地壳中含量最丰富的金属元素,Z原子的最外层电子数是其电子层数的2倍。下列说法错误的是
| A.元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成 |
| B.元素X与W形成的共价化合物有很多种 |
| C.元素W、X的氯化物中,各原子均满足8电子的稳定结构 |
| D.元素Z可与元素X形成共价化合物XZ2 |
两种气态烃组成的混合气体,完全燃烧后得到CO2和H2O 的物质的量随着混合烃物质的量的变化如图所示。则下列对混合烃的判断正确的是
①一定有C2H4②一定 有CH4③一定有
有CH4③一定有 C3H8
C3H8
④可能有C2H2⑤一定没有C2H6⑥可能有C3H4
| A.②⑤⑥ | B.②④ | C.②④⑥ | D.②③ |
某分子式为C10H20O2的酯,在一定条件下可发生如下图的转化过程: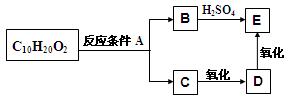
则符合上述条件的酯的结构可有
| A.2种 | B.4种 | C.6种 | D.8种 |
下列离子方程式正确的是
A.乙酸与碳酸钠溶液反应:2H++CO == CO2↑+H2O == CO2↑+H2O |
| B.醋酸溶液与新制氢氧化铜反应:2H++Cu(OH)2—→Cu2++2H2O |
| C.苯酚钠溶液中通入少量二氧化碳: 2C6H5O-+CO2+H2O  2C6H5O 2C6H5O H+CO H+CO |
| D.甲醛溶液与足量的银氨溶液共热 |
HCHO+4[Ag(NH3)2]++4OH- CO
CO +2NH
+2NH +4Ag↓+6NH3+2H2O
+4Ag↓+6NH3+2H2O
黄曲霉素的结构如图,1 mol该化合物分别与H2、NaOH溶液反应,最多消耗H2和 NaOH分别为
| A.6 mol 2 mol | B.7 mol 2 mol |
| C.6 mol 1 mol | D.7 mol 1 mol |
可以将六种无色液体:C2H5OH、AgNO3溶液,C2H5Br、KI溶液,C6H5OH溶液,C6H6一一区分开的试剂是
| A.HCl溶液 | B.溴水 | C.酸性KMnO4溶液 | D.NaOH溶液 |