下列叙述中正确的是
| A.发生化学反应时,失去电子越多的金属原子,其还原能力越强 |
| B.目前已发现118种元素,即已发现118种原子 |
| C.核外电子总数相同的粒子,必定是同种元素的原子 |
| D.同一元素的各种同位素的化学性质基本相同 |
有关简单的烷烃的叙述
(1)都是易燃物(2)特征反应是取代反应(3)相邻两个烷烃在分子组成上相差一个甲基
其中正确的是()
A.(1) 和(3 ) B.(2)和(3) C.只有(1 ) D(1)和(2 )
下列说法正确的是()
| A.分子式相同,元素各百分含量也相同的物质是同种物质 |
| B.通式相同的不同物质一定是同系物 |
| C.分子式相同的不同物质一定是同分异构体 |
| D.相对分子质量相同的不同物质一定是同分异构体 |
甲烷在氧气中燃烧后生成二氧化碳和水,从该实验事实可以得出的结论是( )
| A.甲烷的分子式为CH4 | B.甲烷气体中含碳元素和氢元素 |
| C.甲烷气体中只含碳元素和氢元素 | D.甲烷的化学性质比较稳定 |
下列金属冶炼的反应原理,错误的是()
A.2NaCl(熔融) 2Na+Cl2 2Na+Cl2 |
B.MgO+H2 Mg+H2O Mg+H2O |
C.Fe3O4+4CO  3Fe+4CO2 3Fe+4CO2 |
D.2HgO  2Hg+O2 2Hg+O2 |
下列反应中,属于加成反应的是
| A.CH3Cl+Cl2→CH2Cl2+HCl | B.CH2=CH2+HCl→CH3—CH2Cl |
| C.SO2+2NaOH→Na2SO3+H2O | D.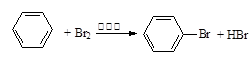 |