化学能和电能的相互转化,是能量转化的重要方式之一,如图两个实验装置是实现化学能和电能相互转化的装置。
(1)把化学能转化为电能的装置是 (填“甲”或“乙”);
(2)甲中②的电极名称为 。
(3)④电极上的电极反应式为 。
(4)①电极上的电极反应式为 ,
检验该电极反应产物的方法是 。
(5)写出装置甲的反应总化学方程式 。
MnO2与过量固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl,K2MnO4溶液经酸化后转化为MnO2和KMnO4。一种MnO2制备KMnO4的方法如下: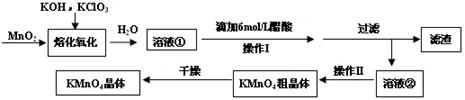
(1)写出“溶化氧化”的化学反应方程式:;
(2)从溶液②中得到KMnO4粗晶体的方法是;
(3)上述流程中可以循环使用的物质是;
(4)理论上(若不考虑制备过程中的损失与物质循环)1mol MnO2可制的mol KMnO4;
(5)已知293K时醋酸钾的溶解度为217g,硫酸钾的溶解度为11.1g,请解释酸化过程中采用醋酸而不采用盐酸或硫酸的原因:
①不采用盐酸的原因:;
②不采用硫酸的原因:。
(6)采用上述流程制备KMnO4产率并不高,为提高产率,还可以采用以下两种方法:
①在K2MnO4溶液中通入氯气,写出该反应的离子方程式;
②电解K2MnO4溶液,电解的总反应离子方程式为。
(16分)化学反应的能量变化、速率、限度是化学研究的重要内容。
(1)有关研究需要得到C3H8(g) = 3C(石墨,s) + 4H2(g)的ΔH,但测定实验难进行。设计下图可计算得到:
①ΔH0(填>、<或=)
②ΔH =
(用图中其它反应的反应热表示)
(2)甲酸、甲醇、甲酸甲酯是重要化工原料。它们的一些性质如下:
| 物质 |
HCOOH |
CH3OH |
HCOOCH3 |
| 主要 性质 |
无色液体,与水互溶 K(HCOOH)>K(CH3COOH) |
无色液体,与水互溶 |
无色液体,在水中溶解度小,与醇互溶 |
工业制备甲酸原理:HCOOCH3(l) + H2O(l) 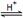 HCOOH(l) + CH3OH(l),反应吸热,但焓变的值很小。常温常压下,水解反应速率和平衡常数都较小。
HCOOH(l) + CH3OH(l),反应吸热,但焓变的值很小。常温常压下,水解反应速率和平衡常数都较小。
①工业生产中,反应起始,在甲酸甲酯和水的混合物中加入少量甲酸和甲醇,从反应速率和限度的角度分析所加甲酸和甲醇对甲酸甲酯水解的影响。
甲醇:。
甲酸:。
某小组通过试验研究反应HCOOCH3转化率随时间变化的趋势,在温度T1下,采用酯水比为1:2进行实验,测得平衡是HCOOCH3的转化率为25%。
②预测HCOOCH3转化率随时间的变化趋势并画图表示。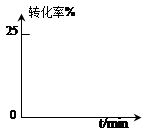
③该反应在温度T1下的平衡常数K=。
(保留两位有效数字)
(3)HCOOH成为质子膜燃料电池的燃料有很好的发展前景。
写出该燃料电池的电极反应式:
。
(16分)对二甲苯(英文名称p-xylene,缩写为PX)是一种低毒化合物,也是聚酯工业的重要原料,主要用于生产对苯二甲酸(PTA),对苯二甲酸再和乙二醇(EG)反应生成聚对苯二甲酸乙二醇酯(PET)。国内对二甲苯产量增长步伐放缓,供应缺口加大,近一半的PX依靠进口。以PX为主要原料生产PET的一种路线如下: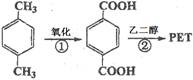
(1)PX可以发生的反应类型有加成反应、、。(填反应类型)
(2)PX的核磁共振氢谱有组峰,峰面积之比为。
(3)反应②的化学方程式为。(不用注明条件)
(4)PX的来源之一是煤的干馏。已知煤干馏副产物煤焦油主要成分有苯、甲苯、混合二甲苯、酚类等,从煤焦油中分离提纯对二甲苯的方法是。
(5)“甲苯甲醇烷基化”制备对二甲苯是一条增产PX的新工艺路线:
写出该反应的化学方程式:。(不用注明条件)
(6)PTA的一种同分异构体X与其含有相同官能团,且其苯环上的一氯取代物有两种,写出化合物X与1,3-丙二醇形成最简单环酯的结构简式:。
海水资源的利用具有广阔前景。海水中主要离子的含量如下:
| 成分 |
含量/(mgL-1) |
成分 |
含量/(mgL-1) |
| Cl- |
18980 |
Ca2+ |
400 |
| Na+ |
10560 |
HCO3- |
142 |
| SO42 |
2560 |
Br- |
64 |
| Mg2+ |
1272 |
电渗析法淡化海水示意图如图所示,其中阴(阳)
离子交换膜仅允许阴(阳)离子通过。
①阳极主要电极反应式是。
②在阴极附近产生少量白色沉淀,其成分有和CaCO3,
生成CaCO3的离子方程式是。
③淡水的出口为(填“a”、“b”或“c”)。
(2)利用海水可以提取溴和镁,提取过程如下: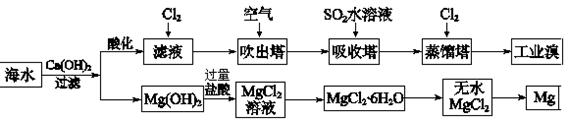
①提取溴的过程中,经过2次Br-→Br2转化的目的是,吸收塔中发生反应的离子方程式是。解释通空气的目的是。
②从MgCl2溶液中得到MgCl2·6H2O晶体的主要操作是、过滤、洗涤、干燥。
③依据上述流程,若将10 m3海水中的溴元素转化为工业溴,至少需要标准状况下Cl2的体积为
L(忽略Cl2溶解,溴的相对原子质量:80)。
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是理想,更是一种值得期待的新的生活方式,请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应化学方程式为:
____C+____K2Cr2O7 + ====___CO2↑+ ____K2SO4 + ____Cr2(SO4)3+ ____H2O
请完成并配平上述化学方程式。
其中氧化剂是________________,氧化产物是_________________
(2)甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
CO(g)+ 2H2(g) CH3OH(g)△H1=-116 kJ·mol-1
CH3OH(g)△H1=-116 kJ·mol-1
①已知: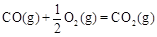 △H2=-283 kJ·mol-1
△H2=-283 kJ·mol-1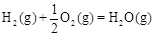 △H3=-242 kJ·mol-1
△H3=-242 kJ·mol-1
则表示1mol气态甲醇完全燃烧生成CO 2和水蒸气时的热化学方程为;
②在容积为1L的恒容容器中,分别研究在230℃、250℃、270℃三种温度下合成甲醇的规律。下图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。请回答: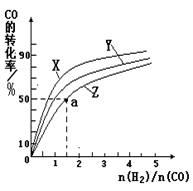
ⅰ)在上述三种温度中,曲线Z对应的温度是
ⅱ)利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+ 2H2(g) CH3OH(g)的平衡常数K=。
CH3OH(g)的平衡常数K=。
③在某温度下,将一定量的CO和H2投入10L的密闭容器中,5min时达到平衡,各物质的物质的浓度(mol•L-1)变化如下表所示:
| 0min |
5min |
10min |
|
| CO |
0.1 |
0.05 |
|
| H2 |
0.2 |
0.2 |
|
| CH3OH |
0 |
0.04 |
0.05 |
若5min~10min只改变了某一条件,所改变的条件是;且该条件所改变的量是。