已知卤代烃可以和钠发生反应,例如溴乙烷与钠发生反应为: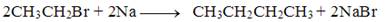
应用这一反应,下列所给化合物中可以与钠合成环丁烷的是
| A.CH3Br | B.CH3CH2CH2CH2Br | C.CH2BrCH2Br | D.CH3CHBrCH2CH2Br |
为研究水滑石的组成、结构和性质,某校研究性学习小组取得了二种牌号的水滑石样品拟进行探究,请你参与探究并回答相关问题。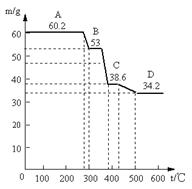
(1)甲同学取天然水滑石样品进行恒重分析,已知天然水滑石的化学式可表示为:6MgO·Al2O3·CO2·12H2O,取0.1mol水滑石进行加热时,温度与剩余固体质量的关系如下图,平行线上的数字表示残留固体的质量。
当温度在0~280℃质量不变,是什么原因:。
A→B减少的物质及其物质的量为:;
C→D减少的物质及其物质的量为:;
D处化学组成为:。
(2)乙组取的CA(美国化学文摘)登记号为12304-65-3 的合成水滑石样品,现只知其化学式为:MgaAlb(OH)C(CO3)d, a+b+c+d="25," a、b、c、d为正整数。取该水滑石样品0.1mol,用1mol/L盐酸使其完全溶解。
①消耗盐酸的体积至少为: L(用字母表示);
②若参加反应的盐酸的物质的量与生成CO2的物质的量之比为18∶1,则该水滑石的化学式为: 。
人类利用太阳能已有3000多年的历史,太阳能科技突飞猛进。塑晶学名为新戊二醇(NPG),它和液晶相似,塑晶在恒温44℃时,白天吸收太阳能而贮存热能,晚上则放出白天贮存的热能。NPG是一种白色结晶固体,熔点124-130℃,沸点210℃,主要作为生产聚酯树脂、无油醇酸树脂等。已知:NPG的结构式为: ,试回答下列问题:
,试回答下列问题:
(1)有关NPG说法正确的是(填序号)。
| A.NPG与乙二醇互为同系物 |
| B.NPG可命名为:2,2-二甲基-1,3-丙二醇 |
| C.NPG一定条件下能发生消去反应 |
| D.研究确定NPG的结构,需经重结晶提纯并干燥、元素定量分析确定分子、相对分子质量测定和波谱分析确定结构 |
(2)已知同一个碳原子连两个羟基该物质不稳定,与NPG互为同分异构体且属于5碳直链稳定的二元醇有: 种;在其所有异构体中,消去2个水分子得到橡胶单体异戊二烯(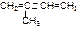 )的二元醇结构可能有:种。
)的二元醇结构可能有:种。
(3)NPG可与丙二酸等物质的量缩聚形成一种用途非常广泛的聚酯,该反应的化学方程式为:。
(4)NPG合成方法之一是利用两种醛加成后再用Cu-ZnO作催化剂加氢得到,已知:
则两种醛的结构简式是:。
(5)二溴新戊二醇 ,是一种纤维类织品的阻燃剂,文献记载二溴新戊二醇的合成方法,“季戊四醇先与浓度在98%以上的醋酸进行酯化反应,再通入溴化氢气体进行取代反应,保温后分离出二溴新戊二醇的二酯化物,然后于0.4-0.6Mpa压力下用甲醇和无机酸进行恒压酯分解,该合成方法反应温度低,生成的粗品二溴新戊二醇含量可达88%左右,产品收率高。”
,是一种纤维类织品的阻燃剂,文献记载二溴新戊二醇的合成方法,“季戊四醇先与浓度在98%以上的醋酸进行酯化反应,再通入溴化氢气体进行取代反应,保温后分离出二溴新戊二醇的二酯化物,然后于0.4-0.6Mpa压力下用甲醇和无机酸进行恒压酯分解,该合成方法反应温度低,生成的粗品二溴新戊二醇含量可达88%左右,产品收率高。”
试补充合成路线(只写相关反应物和相关生成物) →□→□→
→□→□→
已知2-丁烯有顺、反两种异构体,在某条件下两种气体处于平衡,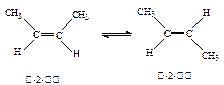 △H=-4.2 kJ/mol
△H=-4.2 kJ/mol (g)+H2(g)→CH3CH2CH2CH3(g) △H=-118.9kJ/mol;
(g)+H2(g)→CH3CH2CH2CH3(g) △H=-118.9kJ/mol;
下列说法正确的是
| A.顺-2-丁烯比反-2-丁烯稳定 | B.顺-2-丁烯的燃烧热比反-2-丁烯大 |
| C.加压和降温有利于平衡向生成顺-2-丁烯反应方向移动 | |
D.反-2-丁烯氢化的热化学方程式为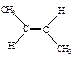 (g)+H2(g)→CH3CH2CH2CH3(g) (g)+H2(g)→CH3CH2CH2CH3(g) |
△H=-114.7kJ/mol
下列说法不正确的是
A.配制FeCl2溶液时,可将FeCl2晶体先溶于浓盐酸,再加水稀释和少量铁屑保存
B.输油管道,为防止其表面被腐蚀应涂上隔水材料并与外电源负极相连
C.pH值均为9的NaOH溶液和Na2CO3溶液,两溶液中水的电离程度相同
D.0.1mol/L 弱酸HA溶液与0.05mol/L NaOH溶液等体积混合后所得溶液微粒浓度间有: 2c(H+)+c(HA) = c(A-)+2 c(OH-)
阿伏加德罗常数约为6.02×1023mol-1,下列说法中正确的是
| A.1molNH3催化氧化完全转变为NO时,转移5×6.02×1023e- |
| B.-140℃下,92g四氧化二氮晶体,恢复到标准状况时,N2O4分子数为6.02×1023个 |
| C.3.9g过氧化钠中含有6.02×1023个O2-离子 |
D.1mol 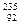 U核素,含有235×6.02×1023个中子 U核素,含有235×6.02×1023个中子 |