化学反应的实质就是旧键的断裂和新键的生成,欲探讨发生化学反应时分子中化学键在何处断裂的问题,近代科技常使用同位素示踪原子法,如有下列方法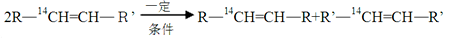
由此可以推知:化合物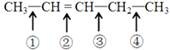 反应时断裂的化学键是
反应时断裂的化学键是
| A.①③ | B.①④ | C.② | D.②③ |
下列有关物理量相应的单位,表达不正确的是
| A.摩尔质量:g |
| B.密度:g·mL-1 |
| C.气体摩尔体积:L·mol-1 |
| D.阿伏加德罗常数:mol -1 |
下列有关胶体的说法正确的是
| A.分散质粒子直径介于10-9 m~10-7m之间的分散系称为胶体 |
| B.电泳现象可证明胶体带有电荷 |
| C.用聚光手电筒照射FeCl3溶液和Fe(OH)3胶体时,产生的现象相同 |
| D.Fe(OH)3难溶于水,因此可以用向煮沸的氢氧化钠溶液中滴加饱和三氯化铁溶液的方法制备氢氧化铁胶体。 |
下列实验操作中正确的是
| A.蒸发氯化钠溶液时,应使混合物中的水分完全蒸干后,才能停止加热 |
| B.蒸馏石油时,应使温度计水银球插入液面以下。 |
| C.分液操作时,下层液体从分液漏斗下口放出,上层液体从上口放到另一个烧杯 |
| D.检验硫酸根离子的操作是先加硝酸酸化再加入氯化钡溶液。 |
下列实验“操作和现象”与“结论”对应关系正确的是
| 操作和现象 |
结论 |
|
| A |
向装有Fe(NO3)2溶液的试管中加入稀H2SO4,在管口观察到红棕色气体 |
HNO3分解生成了NO2 |
| B |
用铂丝蘸取溶液进行颜色反应,观察到火焰呈黄色。 |
该溶液一定是钠盐溶液 |
| C |
向饱和Na2CO3溶液中通入足量CO2,溶液变浑浊 |
析出了NaHCO3 |
| D |
常温下,将Al箔插入浓HNO3中,无明显现象。 |
铝和浓硝酸不反应 |
将一定量的醋酸与一定量的NaOH溶液混合,下列说法中不正确的是
| A.若混合后呈中性,则混合后的溶液中一定存在:c(Na+)=c(CH3COO-)>c(CH3COOH)>c(OH-)=c(H+) |
| B.若混合后呈酸性,则混合后的溶液中可能存在:c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) |
| C.若混合后呈碱性,则混合后的溶液中可能存在:c(Na+)>c(OH-)>c(CH3COO-)>c(CH3COOH)>c(H+) |
| D.若混合后的溶液中存在c(CH3COO-)+c(CH3COOH)=2c(Na+)等式,则也一定存在c(OH-)+c(CH3COO-)=c(CH3COOH)+c(H+)等式 |