反应C(s)+H2O(g) 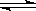 CO(g)+H2(g),在10L密闭容器中进行5分钟后,水蒸气的物质的量减少了0.45mol,则此反应的平均反应速率v(X)可表示为
CO(g)+H2(g),在10L密闭容器中进行5分钟后,水蒸气的物质的量减少了0.45mol,则此反应的平均反应速率v(X)可表示为
A.v(H2)=0.009mol• (L•s) -1 B.v(CO)=0.009mol• (L•min)-1
C.v(C)="0.00015" mol• (L•s) -1 D.v(H2O)=0.09mol• (L•min)-1
化学实验中常将溶液或试剂进行酸化,下列酸化处理的措施正确的是
| A.检验溶液中是否含有SO32-时,用硝酸酸化后再加BaCl2溶液 |
| B.为提高高锰酸钾溶液的氧化能力,用盐酸将高锰酸钾溶液酸化 |
| C.检验溶液中是否含有Fe2+时,用硝酸酸化后,加KSCN溶液 |
| D.检验溶液中是否含有SO42-时,用盐酸酸化后,加BaCl2溶液 |
氧化亚铁粉末和铝粉配成铝热剂,分成两等份。一份在高温下恰好完全反应后,再与盐酸反应;另一份直接放入足量的烧碱溶液中充分反应。前后两种情况下生成的气体的质量比是
| A.1∶1 | B.2∶3 | C. 3∶2 | D.4∶3 |
某学习小组讨论甲、乙、丙、丁四种仪器装置的有关用法,其中不合理的是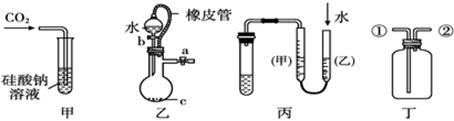
| A.甲装置:可用来证明碳的非金属性比硅强 |
| B.乙装置:橡皮管的作用是能使水顺利流下 |
| C.丙装置:用图示的方法不能检查此装置的气密性 |
| D.丁装置:先从①口进气集满二氧化碳,再从②口进气,可收集氢气 |
CO2与H2的混合气体5g,在150℃时和足量的氧气混合,用电火花充分引燃,在相同状况下,再将反应后所得混合气体通入到足量的Na2O2中,测得Na2O2固体增重的质量为3.4g,则原混合气体中CO2的物质的量分数为
| A.25% | B.75% | C.88% | D.32% |
下列各组物质相互作用时,其中水既不作氧化剂,又不作还原剂,而反应仍属于氧化还原反应的是
| A.二氧化碳与水反应 | B.Na与水反应 |
| C.氨气与水反应 | D.过氧化钠与水反应 |