Ⅰ.对于4FeS2+11O2 ==2Fe2O3+8SO2,试回答有关的问题:
(1)常选用哪些物质浓度的变化来表示该反应的速率 ;
(2)为了提高生成SO2的速率,可以采取的措施是 ;
A.增加FeS2的量 B.增大O2的浓度 C.升高温度 D.减小压强
Ⅱ.某可逆反应在某体积为5L的密闭容器中进行,在从0—3分钟各物质的量的变化情况如下图所示(A,B,C均为气体)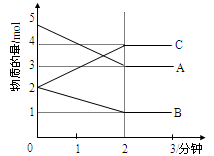
(3)该反应的化学方程式为 ;
(4)在一定温度下,体积不变的密闭容器中,上述反应达到平衡的标志是 (填字母)
A.气体总质量保持不变
B.A、B、C的浓度都相等
C.A、B、C的浓度不再发生变化
D.A、B、C的分子数之比为2∶1∶2
E.正反应和逆反应都已停止
F.容器内气体密度不再发生变化
如图所示,把试管放人盛有25℃饱和石灰水的烧杯中,试管中开始放入固体试剂A,再在试管中用滴管滴入5 mL液体试剂B。可见到烧杯中饱和的澄清石灰水变浑浊。试回答下列问题:
(1)试推测试剂A和B各是什么?(不一定填满,最(最少2组)
| 固体试剂A |
液体试剂B |
|
| ① |
||
| ② |
||
| ③ |
||
| ④ |
(2)解释烧杯中澄清石灰水变浑浊的原因:
_
现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A与D同主族,C与E同主族,D、E、F同周期,A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C形成电子数相等的分子,且A与C形成的化合物常温下为液态,A能分别与E、F形成电子总数相等的气体分子.请回答下列问题(题中字母只代表元素代号,与实际元素符号无关):
(1)B、F可形成三角锥形分子,其电子式为(2分)
(2)B、C、E的气态氢化物沸点由高到低的顺序为:(2分)
(3)C、E形成的化合物通入F的单质的水溶液中,可形成两种强电解质,则该反应的离子方程式为:。
(4)A、B、C可形成常见的化合物H,足量的H的稀溶液与a g Fe完全反应,被还原的H的物质的量为:。
化学电池是 ___的装置,其反应的基础是_。写出铜锌原电池(稀硫酸为电解质)的电极反应:正极,负极。
组装仪器的基本原则是从左到右,从______________
乙炔的电子式__________ ____、为______________型分子
____、为______________型分子